Неоднородность структуры паренхимы с преобладанием мягкоэластического компонента указывает на вариативность клеточной организации и распределения волоконного матрикса в тканях. Это может влиять на механические свойства паренхимы, обеспечивая ей необходимую гибкость и устойчивость к внешним воздействиям.
Такое преобладание мягкоэластического компонента, как правило, обусловлено функциональными требованиями тканей, находящихся в постоянном движении, что требует адаптивных изменений в структуре для обеспечения оптимальной работы органов. Понимание этих особенностей является важным для разработки методов лечения и диагностики заболеваний, связанных с нарушением структуры паренхимы.
- Изучена структура паренхимы с акцентом на неоднородность ее компонентов.
- Подчеркивается преобладание мягкоэластического элемента в общей композиции паренхимы.
- Анализируется влияние мягкоэластического компонента на функциональные свойства ткани.
- Выявлены механизмы, способствующие изменению неоднородности структуры.
- Обсуждаются возможные практические применения полученных данных в медицине и биологии.
Ангиомиолипома (АМЛ) относится к опухолям, специфичным для почек. Эта опухоль вызывает значительный клинический интерес из-за возможности её диагностики перед операцией. Структурно АМЛ включает зрелую жировую ткань, сосуды с утолщёнными стенками и гладкомышечные волокна, которые могут быть представлены в различных пропорциях [1-3].
Как правило, эти опухоли регистрируются у взрослых людей в возрасте от 50 до 70 лет, чаще всего они обнаруживаются односторонне и представлены в виде одиночного узла, расположенного в одном из полюсов почки. Большинство пациентов — женщины [1, 4, 5]. Преобладание жирового компонента формирует типичную картину для АМЛ, что делает её легко идентифицируемой при использовании различных методов лучевой диагностики [1, 4, 6, 7].
К характерным признакам АМЛ в типичных случаях можно отнести: единообразную гиперэхогенную структуру, по экогенности сопоставимую с синусом почки, отсутствие дорсальных эффектов; также отмечается низкая денситометрическая плотность образования или его значительной части, соответствующая плотности жировых тканей [3, 4, 6, 7]. Существуют данные, что выраженное преобладание жировой компонента чаще наблюдается у небольших АМЛ, которые, как правило, протекают бессимптомно и выявляются случайным образом во время ультразвукового исследования (УЗИ) [1, 4, 8, 9]. С увеличением размеров опухоли изменяется соотношение её компонентов и могут возникать вторичные изменения, такие как кровоизлияния и некрозы, что чревато разными осложнениями, наиболее распространённым из которых является спонтанный разрыв опухоли с последующим кровотечением [6, 10].
Однако в литературе описаны наблюдения АМЛ, имеющих атипичную УЗ- и компьютерно-томографическую (КТ) структуру [9, 11-15], что ряд авторов связывают с уменьшением содержания жира в опухоли [16-18] или с преобладанием гладко-мышечного компонента [19]. Наибольшие трудности для дифференциальной диагностики АМЛ почки, по данным большинства отечественных и зарубежных авторов, возникают при почечно-клеточном раке раке почки[12, 20-22]. Отдельного упоминания, по нашему мнению, заслуживает эпителиоидный тип АМЛ, характеризующийся агрессивным течением [22].
Неоднородность структуры паренхимы с преобладанием мягкоэластического компонента является важным аспектом, который необходимо учитывать при анализе функциональных характеристик органа. В таких тканях наблюдается разнообразие клеточных элементов, каждая из которых выполняет свою уникальную роль. Мягкоэластический компонент, который зачастую проявляется в виде коллагеновых и эластиновых волокон, обеспечивает необходимую пластичность и упругость, что позволяет органу адаптироваться к изменяющимся условиям или нагрузкам.
С точки зрения физиологии, такая неоднородность имеет значительное значение для механики тканей. Например, в условиях изменения давления или силы, мягкоэластический компонент помогает снизить риск повреждений, обеспечивая диффузию нагрузки. Это особенно актуально для органной системы, где постоянные механические воздействия могут приводить к дегенеративным процессам. Моё исследование показывают, что уровень эластичности паренхимы может непосредственно влиять на её способность к регенерации и восстановлению после травмы.
На молекулярном уровне неоднородная структура паренхимы с доминированием мягкоэластического компонента также подтверждает наличие отдельных клеточных сигнальных путей, отвечающих за создание и обновление внеклеточного матрикса. Это открывает новые горизонты для разработки терапевтических подходов, направленных на поддержание или восстановление нормальной структуры тканей. Тем самым обеспечивается не только стабильность органа в его функциональных задачах, но и оптимизируется процесс регенерации, что имеет важное значение в клинической практике.
Таким образом, точная диагностика атипичных почечных АМЛ на этапе предоперационного обследования становится настоящей диагностической задачей.
Материалы и методы
Представлены результаты КТ и УЗИ, проведённых у 12 пациентов, не имеющих признаков туберозного склероза, с нетипичной КТ-картиной АМЛ. Для нативных КТ-исследований использовались рентгеновские спиральные томографы GE Hi Speed NX/i Pro и Toshiba Xpress/GX. Внутривенное болюсное контрастирование (n=10) проводилось с применением неионного контрастного средства (Омнипак 300, Ультравист 300) с использованием автоматического шприца, в дозе 100 мл. Сканирование производилось в артериальную, нефрографическую и уро-графическую фазы через 25 и 120 секунд после введения контрастного вещества.
УЗИ проводилось на аппаратах GE Logic 9 и Toshiba Nemio с использованием многочастотных матриксных датчиков, а также режимов нативной гармоники, цветового и энергетического допплеровского картирования (ЦиЭДК).
Результаты и обсуждение
Были проанализированы данные предоперационного обследования 12 пациентов, которым выполняли операции из-за опухолей почек, и послеоперационное гистологическое исследование показало наличие АМЛ.
На основании данных КТ всем больным был установлен диагноз рак почки. Опухоли имели вид неоднородных солидных образований, по плотности соответствовали мягким тканям и при нативном исследовании практически не отличались от окружающей почечной паренхимы. Все образования в исследуемой группе имели средние плотности от 17 до 38 ед.
Средняя плотность паренхимы почки составила 22-39 единиц H. При внутривенном контрастировании (9 случаев) наблюдалось четкое неравномерное накопление контрастного вещества в опухоли с увеличением денситометрических показателей на 56-85 единиц H в артериальную фазу и их последующим снижением на 24-47 единиц H.
При этом интенсивность в 9 случаях была значительно ниже, а в 3 случаях — сопоставима с контрастированием почечной паренхимы, что привело к более заметной неоднородности опухолевых узлов. Преобладали опухоли с экстраренальным расположением, что заставляло четко деформировать наружный контур почки — в 10 случаях (рис. 1, 2). В 2 случаях опухолевые узлы находились интраренально, вызывая деформацию почечного синуса (рис. 3).
Рис. 2. Ультразвуковая картина почечной АМЛ: а — серошкальное изображение, продольное и поперечное сканирование; б — применение режима ЭДК; в — интра-операционное УЗИ; г — макропрепарат удаленной почки. Опухоль на разрезе отчетливо выступает за контур почки, только часть опухоли (указана стрелкой) по внешнему виду сравнима с жировой тканью эхогенности с наличием «сетчатой» внутренней эхоструктуры плотностей. Однако проведенный в дальнейшем ретроспективный анализ позволил обнаружить в опухолях мелкие (до 0,5 см) или точечные включения низкой (от -10 до -14 ед. Н) плотности у 5 больных.
УЗ-картина опухолевых узлов в 10 случаях была типична для АМЛ. Опухоли представляли собой округлые образования с заметно повышенной эхогенностью и мелкосетчатой структурой. В 2 случаях образования имели эхогенность, лишь немного превышающую таковую почечной паренхимы.
Несмотря на данные УЗИ, в 10 наблюдениях решение о тактике ведения больных основывалось на результатах КТ-исследования. Лишь у 2 пациентов после проведения интраоперационного УЗИ было принято решение о выполнении органосохраняющих операций вместо запланированных нефрэктомий. Интраопера-ционный вид опухолей и данные макроскопического исследования препаратов также не были характерны для АМЛ. Лишь плановое послеоперационное гистологическое исследование позволило выявить особенности строения изучаемых опухолей в виде изменения соотношения их структурных компонентов. Практически во всех наблюдениях отмечали преобладание мышечного компонента, состоящего из гладкомы-шечных клеток различной степени зрелости, от вере-
Рис. 4. Патогистологическое исследование. Увеличение х 200. Опухоль состоит из гладкомышечной ткани, небольшого количества долек из липоцитов и хаотично расположенных сосудов.
Полученные результаты показывают, что КТ-признаки исследованных опухолей больше соответствуют почечно-клеточному раку, чем типичным АМЛ, которые на КТ имеют практически однородную структуру с отрицательными значениями.
Рис. 5. Нетипичная почечная АМЛ. КТ-исследование: а — нативное исследование; большая часть образования по денситомет-рическим показателям не отличается от почечной паренхимы; б — в аортальную фазу исследования опухоль неравномерно накапливает контрастный препарат; в — нефрографическая фаза; накопление контрастного препарата в опухоли значительно ниже, чем в неизмененной паренхиме теновидных, формирующих четко очерченные пучки, до более коротких, с нечеткой границей плазмо-леммы и умеренно полиморфными продолговатыми ядрами. Между пучками лейомиоцитов были обнаружены сосудистые щели, выстланные эндотелием (рис. 4).
В качестве примера приводим следующее наблюдение.
Больная С., 48 лет. В начале мая 2006 г. при прохождении профилактического осмотра была выявлена опухоль правой почки. Пациентка направлена на дообследование и лечение в Московскую городскую онкологическую больницу №62 (МГОБ №62). При поступлении жалоб не предъявляла.
На компьютерных томограммах, полученных на догоспитальном этапе обследования, в нижней трети левой почки было обнаружено образование мягкотканевой плотности с неравномерным накоплением контрастного вещества (рис. 5, а, б, в). КТ-картину оценили как рак почки.
По данным предоперационного УЗИ в МГОБ№62 в нижнем полюсе левой почки было выявлено солидное образование округлой формы с повышенной эхогенностью, преимущественно экстраренальным ростом, размером 23 х 18 мм (рис. 6, а). Это образование содержало одиночные обводящие и внутренние сосудистые сигналы (рис. 6, б). УЗИ-картина больше соответствует АМЛ почки.
Чашечно-ло-ханочная система и мочеточник не расширены. Печень и забрюшинное пространство — без особенностей. Учитывая данные КТ, принято решение о хирургическом лечении. На операции (05.07.2004) опухоль желтовато-серого цвета, визуально возникает подозрение на рак почки.
Данные интраоперационного УЗИ оказались практически идентичны полученным ранее: опухоль была резектабельна, эхографическая картина соответствовала АМЛ (рис. 6, в). Учитывая все собранные данные, решено было провести резекцию почки. Макроскопическое исследование препарата показало наличие небольшого жирового участка в центре опухолевого узла, а результаты гистологического исследования подтвердили наличие почечной АМЛ с преобладанием гладкомышечного компонента (рис. 6, г).
Рис. 6. Ультразвуковая картина почечной АМЛ: а — серошкальное изображение; продольное сканирование; б — применение режима ЭДК; в — интраоперационное УЗИ; г — макропрепарат удаленной почки. Опухоль на разрезе отчетливо выступает за контур почки, значительная часть опухолевого узла (стрелки) по внешнему виду сравнима с почечной паренхимой
Подводя итоги, можно заметить, что преобладание гладкомышечного компонента в структуре почечных АМЛ формирует КТ-картину, которая больше соответствует почечно-клеточному раку из-за своей неоднородности в нативном режиме, мягкотканевой плотности и неравномерного накопления контраста. Это значительно усложняет точное распознавание таких опухолей и может приводить к гипердиагностике рака почки.
В то же время, несмотря на морфологические особенности АМЛ, УЗ-картина остается типичной для данной патологии. Таким образом, эффективность спиральной КТ в диагностике атипичных АМЛ уступает УЗИ. Для принятия решения о выполнении органосохраняющих операций целесообразно выполнение интраоперационного УЗИ.
1. Руководство по клинической урологии. Переведено с английского. Под редакцией Ф.М. Ханко, С.Б.
Манивича, А. Дж. Вейна. 3-е изд. М., ООО «Медицинское информационное агентство»; 2006. с. 306.
2. Самсонов В.А. Патоморфология опухолей почек и верхних мочевыводящих путей. М., Медицина; 1981.
3. Attyaoui F., Binous M.Y., Sallami S. и др. Ангиомиолипома почки. Tunis Med 2003;81(1):1-4.
4. Воронин Д.В. Лучевая диагностика ангиомиолипомы почки: Дис. . канд. мед. наук. М.; 1999. 110 с.
5. Справочник по онкологии. Под редакцией акад. РАМН Н.Н. Трапезникова и проф. И.В.
Поддубной.
Онкоцентр РАМН. Справочная библиотека врача. Вып. 4.
6. Bulto Monteverde J.A., Talens A., Navalon P. et al. Renal angiomyolipoma.
ОНКОУРОЛОГИЯ 22008 Диагностика и лечение опухолей мочеполовой системы.
Ultrasonography and computerized tomography findings. Arch Esp Urol
7. Zebedin D., Kammerhuber F., Uggowitzer M.M. и др. Критерии для ультразвуковой дифференциации малых ангиомиолипом (< или = 3 см) и почечно-клеточных карцином. Rofo Fortschr Geb Rontgenstr Neuen Bildgeb Verfahr 1998;69(6):627-32.
8. Ascenti G., Zimbaro G., Mazziotti S. и др. Полезность допплеровской ультрасонографии и контрастной сонографии в дифференциации гиперэхогенных почечных масс. Abdom Imaging. 2001;26(6):654-60.
9. Ikeda A.K., Korobkin M., Platt J.F. et al. Small echogenic renal masses: how often is computed tomography used to confirm the sonographic suspicion of angiomyolipoma?
10. Nakai M., Nakamura N. Доклад о спонтанном разрыве почечно-клеточного карцинома, который был трудно отличить от ангиомиолипомы. Hinyokika Kiyo
11. Esparza P.P., Sarasua M.A., de Andoin Barandiaran G.N. et al. Renal angiomyolipoma: a case with a difficult diagnosis. An Esp Pediatr 2002;57(5):495-7.
12. Matveev V.B., Volkova M.I., Kudashev B.V. и др. Диагностические сложности в редких вариантах почечной ангиомиолипомы. Урология 2000;(4):22-6.
13. Obuz F., Karabay N., Secil M. и др. Различные радиологические проявления ангиомиолипом в одной почке. Eur
14. Pozzi Mucelli R., Locatelli M. Renal angiomyolipoma: typical and atypical features. Radiol Med
15. Pozzi-Mucelli F., Pozzi-Mucelli R.S., Melato M. и др. Почечные ангиомиолипомы: атипичные проявления на ультразвуке и компьютерной томографии. Radiol Med
16. Bennett W.F., Bova J.G., Vaswani K. Case 2. Angiomyolipoma with minimal fat content. AJR Am J Roentgenol
17. Hosokawa Y., Kinouchi T., Sawai Y. и др. Почечная ангиомиолипома с минимальным количеством жира. Int J Clin Oncol 2002;7(2):120-3.
18. Jinzaki M., Tanimoto A., Narimatsu Y. и др. Ангиомиолипома: визуализационные данные в очагах с минимальным содержанием жира. Radiology
19. Ohkawa M., Kadoya M., Nonomura A. Renal angiomyolipoma composed primarily of smooth muscle element: diagnostic
considerations. Urol Int 1995;54(4):230-3.
20. Bernardini S., Chabannes E., Algros M.P. et al. Variants of renal angiomyolipo-ma closely simulating renal cell carcinoma: difficulties in the histological diagnosis. Urol Int 2002;69(1):78-81.
21. Jimenez R.E., Eble J.N., Reuter V.E. и др. Одновременное наличие ангиомиолипомы и почечной клеточной неоплазии: исследование 36 случаев. Mod Pathol 2001;14(3):157-63.
22. Tsujimura A., Miki T., Gotoh T. и др. Почечно-клеточный рак с жировым компонентом, имитирующий ангиомиолипому на КТ. Br J Radiol 1998;71(849):977-9.
23. Cibas E.S., Goss G.A., Kulke M.H. et al. Malignant epithelioid angiomyolipoma (‘sarcoma ex angiomyolipoma‘) of the kidney: a case report and review of the literature. Am J Surg Pathol 2001;25(1):121-6.
Прогностическая значимость диагностических критериев оценки эффективности лечения диффузных гиперпластических процессов молочной железы
Актуальность. В современном медицинском сообществе актуальной остается проблема заболеваний молочной железы. Рак молочной железы стабильно занимает лидирующую позицию среди онкологических заболеваний в женской репродуктивной системе [1]. Кроме этого, отмечается высокая распространенность доброкачественных изменений в молочных железах, крупнейшей группой которых являются формы диффузной фиброзно-кистозной мастопатии (ДФКМ). В последнее время всё больше авторов начинают использовать термин гиперпластические процессы молочной железы [2], что отражает морфологические изменения при различных формах диффузных мастопатий.
Своевременная диагностика и лечение таких состояний важна в силу многих причин. Основная из них, это риск развития рака молочной железы при пролиферативных формах заболевания [7,8], так же наличие выраженной клинической симптоматики и психологического дискомфорта у женщины при выявлении ДФКМ [3]. В настоящее время существует множество методов лечения ДФКМ, включающих в себя гормональную и негормональную терапию, но до сих пор нет единых критериев оценки эффективности проводимой фармакологической коррекции.
Цель настоящего исследования состоит в установлении диагностических критериев для оценки эффективности лечения различных форм диффузной фиброзно-кистозной мастопатии.
Материалы и методы: С начала января и до конца декабря 2011 года в Президентском медицинском центре города Астана 1076 женщин в возрасте от 35 до 75 лет прошли исследование цифровой маммографии в соответствии со стандартной методикой. Для проведения дополнительного ультразвукового исследования использовался мультичастотный линейный датчик с диапазоном 7,5-10 мГц. Ультразвуковое исследование выполнялось по модифицированной стандартной методике (по Солнцевой И. А.), при этом измерялась толщина железистой ткани от переднего до заднего листка фасции в точке с максимальной толщиной железистого слоя с целью выявления гиперплазии. У менструирующих пациенток УЗИ проводилось с 6 по 12 день менструального цикла.
Так же была проведена допплерография артерий паренхимы молочных желез с регистрацией основных допплерометрических показателей: максимальной (пиковой) систолической скорости кровотока (Vmax.sist), конечной диастолической скорости кровотока (Vend.sist), средней линейной скорости (TAMX), пульсационного индекса (PI), индекса резистентности (RI), систоло-диастолического (S/D) отношения, характеристики спектрограмм.
Кровоток в молочной железе характеризуется артериальным типом с низким уровнем периферического сопротивления, при этом выделяют два основных спектральных пика – систолический и диастолический. Максимальная систолическая скорость, индекс резистентности (RI) и пульсационный индекс (PI) предоставляют особенно важные диагностические данные. Согласно данным Заболотской Н. В., артерии паренхимы молочных желез имеют среднюю максимальную скорость Vmax.sist 10,13 см/сек [2], с возможностью достижения значений вплоть до 16,1 см/сек. В период с 1997 по 2004 год авторы представили нормальные значения RI при оценке индексов резистентности и пульсационного индекса.
В нашем исследовании за норму были приняты значения RI от 0,55 до 0,75 и PI
Перед проведением комплексного рентгено-ультразвукового исследования проводилось клиническое обследование, в состав которого входили сбор анамнеза, осмотр и пальпация молочных желез. В случае наличия выделений из соска, осуществлялось цитологическое исследование отделяемого. Также тонкоигольная аспирационная биопсия (ТАБ) под ультразвуковым контролем выполнялась при наличии кист более 10 мм с последующим анализом полученного аспирата.
Для оценки результатов лечения диффузной фиброзно-кистозной мастопатии была сформирована основная группа (группа 1), состоящая из 159 женщин в возрасте от 35 до 55 лет (в среднем 45 ± 10 лет). Включение в исследование происходило при наличии диффузной фиброзно-кистозной мастопатии, независимо от формы и выраженности, а также при отсутствии атипичных клеток в цитологических анализах. Исключались пациенты с узловыми образованием в молочных железах, подозрительными на малигнизацию клетками, использовавшие гормональные контрацептивы или заместительную гормонотерапию в последние 6 месяцев, а также беременные и кормящие женщины в течение последних двух лет до обследования. Для группы сравнения (группа 2) были выбраны 28 женщин того же возрастного диапазона с различными формами диффузной фиброзно-кистозной мастопатии, которые отказались от лечения и находились под динамическим наблюдением.
Для постановки диагноза диффузная фиброзно-кистозная мастопатия мы использовали данные клинического исследования и классификацию Н. И. Рожковой [4], которая выделяет формы с преобладанием железистого компонента (аденоз), фиброзного, кистозного компонентов и смешанную форму ДФКМ. Степень выраженности диффузной мастопатии мы определяли при ультразвуковом исследовании по изменению толщины паренхимы по отношению к возрастной норме (по Солнцевой И. А). При этом, незначительно выраженная диффузная мастопатия характеризуется увеличением толщины паренхимы на 3-7 мм по отношению к средним показателям возрастной группы, умеренно выраженная — на 8-12 мм, резко выраженная — на 13-18 мм. Возрастная норма для женщин в возрасте от 35 до 44 лет составляет 10,5мм±2,5мм, от 45 до 55 – 7,8мм±1,9мм [5].
После установления диагноза диффузной фиброзно-кистозной мастопатии, пациенткам основной группы было назначено лечение, которое включало фитотерапию, витамины, йодотерапию, иммуномодуляторы, седативные средства и гепатопротекторы. Длительность курса лечения составила 6 месяцев. Эффективность терапии оценивалась через 1, 3, 6, 9 и 12 месяцев по ультразвуковым и допплерографическим критериям, а через 12 месяцев проводилась оценка маммографических параметров.
Для обработки полученных данных мы использовали методы описательной статистики, включающие в себя оценку среднего арифметического (М), среднюю ошибку средней арифметической (m), среднюю ошибку среднего значения (t). Для оценки межгрупповых различий значений признаков применяли t-критерий Стьюдента.
Результаты и обсуждение: Цитологическое исследование было проведено у 94 (61,3%) женщин из основной группы; из них у 37 (39,4%) была исследована отделяемое из соска, 26 (27,7%) пациенток прошли ТАБ кист с последующим цитологическим анализом, а 31 (32,9%) женщине проведены как анализ выделений, так и ТАБ кистозных образований.
Согласно результатам цитологического исследования, признаки пролиферации (высокая клеточность образца, наличие клеточных комплексов железистого эпителия с одиночными фигурами митозов, разволокнение хроматина, увеличение числа ядрышек, участки перинуклеарных просветлений и вакуолизация цитоплазмы) были выявлены в 26 (27,7%) случаях. Эти изменения преобладали в случаях мастопатий с кистозным компонентом (12 (46,2%)) и выраженными аденозами (7 (26,9%)).
По данным рентгено-ультразвукового исследования, выявленные мастопатии были распределены в зависимости от формы и степени выраженности. Распределение ДФКМ по форме и степени выраженности представлено в табл. 1.
Таблица 1. Распределение диффузных мастопатий в зависимости от формы и степени выраженности в двух группах

Примечание: р – уровень значимости.
В основной группе чаще всего встречались диффузные фиброзно-кистозные мастопатии смешанной формы – у 54 (35%) пациенток, и с железистым компонентом – у 51 (33,3%). По степени выраженности наблюдались резко выраженные формы у 72 (47,1%) женщин и средние формы у 56 (36,6%). Эти варианты, на наш взгляд, проявляют наиболее яркие клинические симптомы. Так, 112 (73,2%) женщин испытывали масталгию и мастодинию; выделения из сосков различного характера (молозивные, зеленоватые, сероватые и др.) наблюдались у 57 (37,3%) пациенток. При пальпации у 134 (87,6%) женщин обнаруживались уплотнения и неоднородная структура молочных желез. В группе сравнения диффузные мастопатии смешанной формы также наблюдались чаще – у 12 (42,9%) пациенток, а с железистым компонентом – у 9 (32,1%). Однако клинические симптомы, такие как масталгия и мастодиния, определялись реже – у 8 (28,6%) женщин, что зачастую приводило к отказу от лечения.
Маммограммы оценивались по качественным и количественным параметрам: интенсивность теней железистого треугольника (интенсивная, средняя, низкая), структура (однородная, неоднородная), соотношение жировой и железистой ткани (преобладает железистая, равное количество двух тканей, преобладает жировая), мелкие теневые образования в участках лобулярной гиперплазии (множественные – более 10, единичные – до 10), локальные тени, соответствующие кистам диаметром ≤ 10 мм, и фокусные тени, соответствующие кистам более 10 мм.
В основной группе до лечения высокая интенсивность железистого треугольника, характерная для плотной железистой ткани определялась в 97 (61%) случаях исследования, неоднородность присутствовала в 134 (84,3%) маммографических изображениях. В 38 (28,4%) случаях неоднородность была обусловлена наличием мелкоочаговых теней, соответствующих участкам лобулярной гиперплазии, в 24 (17,9%) наличием очаговых и фокусных теней, соответствующих кистам, в 72 (53,7%) наблюдениях определялось сочетание данных признаков.
В 65 (40,9%) случаях неоднородная ткань была связана с утолщением связок Купера, которые хаотично пересекали молочную ткань. Преобладание железистой ткани отмечалось у 86 (54,1%) пациенток. Следует подчеркнуть, что выраженность железистого компонента на маммограммах не всегда соответствовала наличию гиперплазии при последующих ультразвуковых исследованиях; наоборот, даже при минимальной рентгенологической выраженности железистого компонента по УЗИ обнаруживались признаки гиперплазии. Таким образом, для точного инструментального определения гиперпластических процессов в молочных железах у женщин старше 35 лет необходимо проводить как маммографию, так и ультразвуковое исследование.
При анализе маммограмм в группе сравнения высокая интенсивность определялась в 17 случаях (60,7%), неоднородность структуры в 23 (82,1%), преобладание железистой ткани в структуре в 16 (57,1) случаях, выраженный фиброзный компонент в виде утолщенных связок Купера наблюдался у 13 (46,4%) пациенток.
В процессе ультразвукового исследования в обеих группах оценивались следующие характеристики диффузной мастопатии: гиперплазия железистой ткани (изменение толщины по сравнению с возрастной нормой), количество и размер кист, дуктоэктазии, изменения эхогенности железистой ткани (повышение – приближение к эхогенности связок Купера, снижение – приближение к эхогенности протоков), неоднородность структуры железистой ткани, утолщение связок Купера более 1 мм. Все указанные признаки анализировались через 1, 3, 6, 9 и 12 месяцев.
По данным УЗИ в первой группе при наличии диффузной мастопатии гиперплазия железистой ткани наблюдалась у 137 (86,2%) пациенток, кисты разных размеров у 94 (59,1%), дуктоэктазии встречались у 72 (45,3%) случая, изменения эхогенности ткани отмечались в 117 (73,6%) наблюдениях, неоднородность структуры в 125 (78,6%), при этом утолщение связок Купера более 1 мм наблюдалось в 69 (43,4%) случаях.
В группе сравнения гиперплазия железистой ткани определялась у 21 (75%) пациентки, кисты различного количества и размеров у 23 (82,1%), дуктоэктазии встречались в 25 (89,3%) случаях, изменение эхогенности железистой ткани наблюдалось в 21 (75%) случае, неоднородность структуры в 25 (89,3%), утолщение связок Купера более 1 мм в 14 (50%) случаях.
В ходе допплерографического исследования регистрации кровотока в артериях молочной железы не всегда удается достичь [2]. Поскольку исследование проводилось в первой фазе менструального цикла, у большинства женщин артерии паренхимы не визуализировались. Допплерография артерий паренхимы молочной железы с высоким уровнем чувствительности была выполнена у 51 (32,1%) пациентки основной группы, и визуализация артерий чаще проходила в случаях резко выраженных форм диффузной фиброзно-кистозной мастопатии с наличием железистого и кистозного компонентов. Также именно в этих случаях при цитологическом исследовании отмечались признаки пролиферации.
Артерии паренхимы в нашем исследовании обычно определялись в верхненаружных квадрантах в количестве от 1 до 5 в каждой молочной железе. При анализе спектрограмм все они имели магистральный тип кровотока с низким периферическим сопротивлением, определялись симметрично в обеих молочных железах. У 16 (31,4%) пациенток показатели кровотока оказались в пределах нормы (Vmax.sist от 10 до 16 см/сек, RI от 0,55 до 0,75 и PI < 1,0), у 23 (45,1%) пациенток на фоне сохранения нормальных значений максимальной скорости отмечалось снижение RI до 0,42 и повышение PI до 8,0. В 12 (23,5%) случаях отмечалось повышение максимальной систолической скорости до 28-33 см/сек, снижение RI до 0,28-0,45 и повышение PI до 9,0-13,0. Мы связываем изменение скоростных показателей, сосудистого и периферического сопротивления с явлениями неоангиогенеза и пролиферации ткани молочной железы.
При ультразвуковом исследовании женщин из основной группы через месяц после начала терапии была отмечена небольшая положительная динамика: гиперплазия железистой ткани снизилась у 6 (4,4%) пациенток, а структура железистой ткани стала более однородной у 9 (7,2%) пациенток.
По ультразвуковым критериям через три месяца после начала лечения у 42 (30,7%) пациенток наблюдалось уменьшение гиперплазии железистой ткани, у 26 (27,7%) заметно сократилось количество кист, причем больший эффект был у кист диаметром до 10 мм (37,5%). Также было зафиксировано снижение количества расширенных протоков (дуктоэктазий) в 21 (29,2%) случае. Нормализация эхогенности железистой ткани достигнута у 36 (30,8%) пациенток.
Через 6 месяцев лечения гиперплазия железистой ткани определялась у 43(31,4%) пациенток, а в 94 (68,6%) случаях толщина железистой ткани достигла нормальных возрастных показателей. Количество кист молочных желез уменьшилось у 66 (50,4%) пациенток.
Следует отметить, что лечение хорошо действовало как на единичные, так и на множественные кисты размером до 10 мм, однако более крупные кисты нередко оставались стабильными на фоне терапии. У 27 (71,1%) пациенток с кистами размером более 10 мм после аспирации и лечения повторного заполнения кист не произошло. Дуктоэктазии молочных желез обнаружены у 28 (38,9%) пациенток, причем единичные случаи поддавались терапии лучше – были замечены в 30 (41,7%) случаях. Эхогенность железистой ткани оценивалась как изоэхогенная у 65 (55,6%) пациенток, а структура железистой ткани приобрела однородность у 71 (56,8%) женщин после 6 месяцев лечения.
После окончания 6-тимесячного курса лечения все пациентки были поставлены на динамическое наблюдение, которое было проведено через 9 и 12 месяцев после начала терапии. Через 9 месяцев мы наблюдали продолжение положительного терапевтического эффекта, так, нормализация толщины пласта железистой ткани наблюдалась еще у 9 (6,6%) пациенток, уменьшилось количество единичных кист у 18 женщин (16,5%), так же продолжалась нормализация эхогенности и структуры железистой ткани – у 16 (13,7%) и 22 (17,6%) пациенток соответственно.
В процессе динамического допплерографического обследования, проведенного через три месяца после начала терапии, не было отмечено значительных изменений в показателях. Однако при обследовании спустя шесть месяцев у 34 (66,7%) пациенток спектральные показатели кровотока стали нормальными. Через девять месяцев нормализация допплерометрических значений произошла ещё у 6 (11,8%) женщин. Через год после начала лечения мы наблюдали увеличение скоростных параметров и снижение значений RI и PI у 4 (7,8%) пациенток при рецидиве диффузной фиброзно-кистозной мастопатии.
Контрольное комплексное рентгено-ультразвуковое обследование, по нашему мнению, имеет первостепенное значение и должно проводиться через шесть месяцев после завершения лечения. У 24 (17,5%) пациенток был зафиксирован рецидив гиперплазии железистой ткани, в 4 (3,1%) случаях увеличилось количество кистозных образований и дуктоэктазий, а в 18 (15,4%) случаях изменилась эхогенность железистой ткани. Устойчивый терапевтический эффект был замечен в отношении однородности структуры железистой ткани и толщины связок Купера. Динамика ультразвуковых исследований, показывающая ухудшение состояния, была интерпретирована как рецидивирующее течение диффузной фиброзно-кистозной мастопатии, что требует постоянного наблюдения, повторных лечебных курсов или корректировки схемы лечения. Мониторинг ультразвуковых характеристик диффузных гиперпластических процессов молочных желез на фоне терапии изображен на рис. 1.

Рис. 1. Мониторинг ультразвуковых критериев диффузных гиперпластических процессов молочных желез на фоне лечения.
В результате динамического сравнения маммограмм через год было установлено, что интенсивность железистого треугольника сократилась с высокой до средней и низкой в 34 (35,1%) случаях. Структура молочных желез стала более однородной на 62 (46,3%) маммограммах, при этом однородность наблюдалась в 18 (29%) случаях благодаря отсутствию мелкоочаговых теней, указывающих на лобулярную гиперплазию, в 13 (21%) случаях отсутствовали очаговые тени, соответствующие кистам, и в 31 (50%) наблюдениях отсутствовали как признаки лобулярной гиперплазии, так и кистозные изменения.
При анализе изменений в молочных железах у пациенток группы сравнения по данным УЗИ мы отметили отрицательную динамику. Так, гиперплазия железистой ткани и количество кист увеличились у 3 (10,1%) женщин, эхогенность железистой ткани снизилась у 4 (14,3%). Усиление клинической симптоматики отметили 5 (17,9%) пациенток. При анализе маммограмм рентгенологическая картина через год была оценена, как стабильная. Мониторинг ультразвуковых критериев диффузных гиперпластических процессов молочных желез без лечения представлен на рис. 2.

Рис. 2. Мониторинг ультразвуковых признаков диффузных гиперпластических процессов молочных желез без лечения.
Выводы
1. На основании вышеизложенного, по данным нашего исследования, определены маммографические критерии оценки эффективности лечения диффузных гиперпластических процессов молочной железы, это: уменьшение интенсивности тени железистого треугольника, количества мелкоочаговых теней, соответствующих участкам лобулярной гиперплазии, количества очаговых и фокусных теней, соответствующих кистам, уменьшение толщины связок Купера до ≤1 мм, а также однородность структуры железистой ткани в динамике.
2. Основными ультразвуковыми критериям для оценки результата лечения стали: сокращение толщины железистой ткани до нормальных возрастных значений, снижение толщины связок Купера до ≤1 мм, уменьшение диаметра и количества кист и дуктоэктазий, а также нормализация эхогенности железистой ткани и ее однородность на протяжении наблюдения.
3. Допплерометрическими критериями эффективности лечения могут служить: уменьшение количества артерий в паренхиме молочных желез, снижение повышенной максимальной систолической скорости Vmax.sist до 11-16 см/сек, повышение значений RI до 0,55-0,75 и снижение PI до 1,0. Мы считаем, что допплерография в оценке эффективности лечения ДФКМ является перспективной и требует дальнейшего исследования.
4. Для диагностики, дифференциальной диагностики и оценки результативности лечения диффузных гиперпластических процессов молочных желез важно активное сотрудничество врачей-онкологов и маммологов с радиологами. Женщинам в возрасте от 35 до 55 лет необходимо использовать комплексный подход, включающий клиническое, лабораторное, маммографическое, ультразвуковое и допплерографическое обследование с регулярным контролем этих методов на протяжении года, чтобы вовремя выявлять рецидивирующие формы диффузной фиброзно-кистозной мастопатии с признаками пролиферации и оценивать эффективность лечения для возможной коррекции или продления prescribed терапии.
Список использованных источников:
1. Аксель Е. М. Злокачественные новообразования молочной железы: состояние онкологической помощи, заболеваемость и смертность // Маммология. — 2006. — № 1. — С. 9-13.
2. Заболотская Н. В., Заболотский В. С. Новые технологии ультразвуковой маммографии. Практическое руководство. — М.: ООО «Фирма СТРОМ», 2010. — С. 64-80.
3. Коган И. Ю. Гиперпластические процессы в молочных железах у женщин (патогенез, диагностика, прогнозирование течения): автореф. дис. … д-ра мед. наук. — СПб. 2008.
4. Рожкова Н. И., Солодкий В. А. Диффузные доброкачественные заболевания молочной железы. Диагностика и лечение: руководство для врачей. – М.: Спец. изд-во мед. кн., 2012. — С.9-13.
5. Труфанов Г. Е., Рязанов В. В., Иванова Л. И. УЗИ в маммологии. – СПб.: «ЭЛБИ-СПб», 2008. – С.74.
6. Hollerweger A., Rettenbacher T., Machiner P. et al. New signs of breast cancer: high resistant flow and variations in resistive indices evaluation by color Doppler sonography // Ultrasound in Medicine and biology. – 1997.- 23(6). – Р. 851-856.
7. London R. S., Sundaram G. S., Goldstein P. J. Medical Management of Mammary Dysplasia // Obstet. Gynecol. — 1982. -Vol.59, N4. — P.519-523.
8. Hartmann L. C., Sellers T. A., Frost M. H. et al. Benign Breast Disease and the Risk of Breast Cancer // NEJM. — 2005. — Vol.353, N 3. — P.229-237.
9. Stavros A. T. Doppler evaluation of the Breast. Breast Ultrasound 1st ed. — Philadelphia, PA; Lippincott WillyamsWilkins, 2003. –Р. 920-946.
Подписано в печать: 01.07.2014
Симптомы
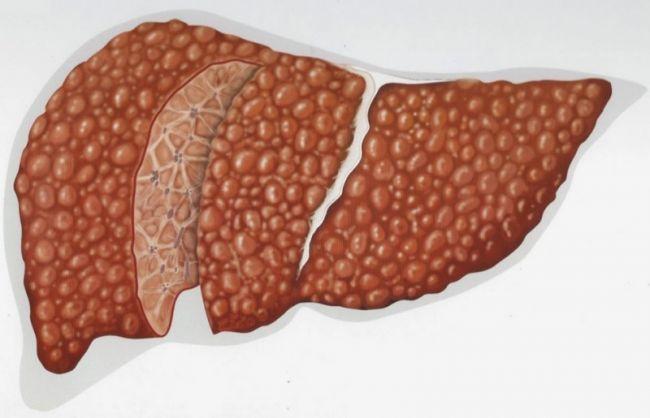
Нередко ДИП имеет стёртое течение, то есть выраженная симптоматика отсутствует. Однако можно выделить следующие признаки диффузных изменений печени:
- Болевые ощущения умеренной интенсивности справа под рёбрами.
- Ощущение тяжести или дискомфорта в правом предплечье.
- Покраснение кожи и желтушность слизистых оболочек.

Желтуха является одним из признаков ДИП
Если пациент заметил подобные симптомы, следует посетить врача.
Для определения степени диффузного поражения органа выполняют ультразвуковое исследование. Отклонения могут появляться как при первичном заболевании, так и в результате аномальных изменений за пределами печени. Например, амилоидоз (поражение печени и других органов амилоидом) может приводить к изменению эхоструктуры печени. При этом могут наблюдаться следующие признаки: гепатомегалия, повышенная эхогенность печени с затуханием в дальних отделах, неоднородность структуры, гранулярная эхографическая картина, сглаженный сосудистый рисунок.
Патология печени и поджелудочной железы
Поджелудочная железа – это непарный орган ЖКТ без полости. Между ней и печенью проходят протоки, и нарушение функции одного из органов может сказаться на другом.

При патологии печени нарушается функциональность поджелудочной железы
Диффузные изменения в обоих органах могут возникнуть по следующим причинам:
- Обменные расстройства.
- Сосудистые заболевания.
- Инфекции, как острые, так и хронические.
Обширное поражение печени и поджелудочной проявляются пожелтением кожных покровов, слизистой оболочки глаз, потемнением мочи, обесцвечиванием каловых масс. При расстройстве функциональности желчеобразующей железы возникает зуд кожных покровов. Это обусловлено тем, что в кровь проникает много желчи.
В ткани поджелудочной железы могут происходить изменения вследствие отёков, воспалительных процессов и липоматоза (появление множества липом в подкожной клетчатке). Этот процесс также может быть вызван фиброзом на фоне воспалительных реакций и обменных нарушений.
Метастазы рака молочной железы на УЗИ
Метастазирование в молочную железу встречается в 1–6% случаев среди всех злокачественных образований. Первичный очаг может находиться в легких, желудочно-кишечном тракте, органах малого таза, мочевом пузыре или контрлатеральной молочной железе. Метастатические образования могут быть как единичными, так и множественными.
Они могут пальпироваться или нет. Поражение может быть односторонним или двусторонним, с вовлечением лимфатических узлов или без него. При ультразвуковой маммографии определяется образование неоднородной структуры, гипоэхогенное, округлой формы с довольно ровными и четкими контурами. Появление гиперэхогенной капсулы (участков десмоплазии) на УЗИ молочной железы нетипично.
Как правило, метастазы, в отличие от первичных опухолей, чаще располагаются в подкожной зоне. Они могут быть основным признаком онкологического заболевания у пациенток, у которых первичный очаг не обнаружен, или же фиксироваться в молочной железе на более поздних стадиях. В обоих случаях важно провести аспирационную биопсию для подтверждения диагноза, поскольку маммографические и эхографические переосмысления не являются специфичными. Например, на маммограммах визуализируются хорошо очерченные множественные округлые затемнения, которые сложно отличить от кист.
- Ультразвуковое исследование при раке молочной железы (часть 1)
- Подготовка для УЗИ молочных желез
- Ультразвуковое обследование заболеваний молочной железы
Причины диффузной мастопатии
Точные причины диффузной мастопатии не всегда удается идентифицировать. Факторами риска доброкачественной дисплазии молочной железы являются:
- Конфликты и стрессы;
- Неудовлетворенность жизнью;
- Неправильное питание (избыточное потребление животных жиров и сахара, нехватка овощей и фруктов, богатых клетчаткой, витаминами и минералами);
- Ранняя менструация;
- Поздний климакс;
- Поздние роды (после 35 лет);
- Множественные аборты;
- Короткие или отсутствующие сроки грудного вскармливания;
- Ановуляторные циклы;
- Воспаления органов малого таза;
- Опухоли яичников;
- Эндокринные заболевания женских половых органов (например, миома матки, гиперпластические процессы в эндометрии, эндометриоз);
- Сахарный диабет;
- Нарушения работы щитовидной железы;
- Дисфункция коры надпочечников;
- Повышенный уровень пролактина в крови;
- Длительность гормонотерапии во время менопаузы более 8-15 лет;
- Мутации в генах типа BRCA 1 и 2.
В широком смысле эстрогены могут рассматриваться как универсальные пролиферативные агенты тканей, тогда как прогестерон выступает в роли антагониста, тормозя клеточное деление. Пролактин отвечает за активацию обменных процессов.

Что нужно сделать при неблагоприятных результатах УЗИ почек
В данном случае специалист-уролог может предоставить подробную информацию об обнаруженных аномалиях и назначить дополнительные обследования:
- Общий анализ крови. При болезнях почек может развиться анемия из-за дефицита гормона эритропоэтина, что приводит к снижению выработки эритроцитов. В некоторых случаях в почечной ткани может образоваться опухоль, которая вырабатывает повышенное количество этого гормона. При воспалительных процессах наблюдается ускорение СОЭ и возрастание числа лейкоцитов.
- Анализ мочи. В случае воспалений в моче могут быть обнаружены следы крови и гноя. При раке почек мочеиспускание может сопровождаться значительными кровотечениями. При нарушении функции почек тесты могут выявить наличие белка.
- Разнообразные пробы мочи для выявления её состава, суточного объёма и других характеристик.
- Анализ мочи на микрофлору и определение чувствительности к антибиотикам. Данный тест назначают при подозрениях на наличие инфекций.
- Биохимический анализ крови. В рамках этого исследования анализируются такие показатели, как креатинин, мочевина, мочевая кислота, общий белок, остаточный азот, а также электролиты — натрий и хлор.
Лечение
По результатам УЗИ и других диагностик больному назначают лечение, которое может быть:
- консервативный подход — использование медикаментов, лечебных процедур и других методов, не требующих хирургического вмешательства;
- хирургический метод — оперативное устранение заболеваний или патологий.
В ходе терапии часто требуется повторное ультразвуковое обследование. Это абсолютно безопасно, так как ультразвук не оказывает негативного влияния на организм. Такие процедуры можно проводить неограниченное количество раз без риска для здоровья.