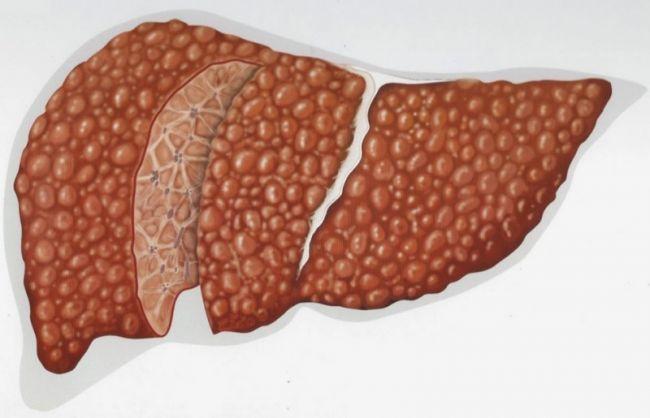
При жировом гепатозе печени критическими считаются показатели трансаминаз (АЛТ и АСТ), превышающие норму более чем в 2-3 раза. Обычно уровень АЛТ может быть в пределах от 7 до 56 единиц на литр, а АСТ – от 5 до 40 единиц на литр. Соответственно, при значениях выше указанных диапазонов стоит насторожиться и провести дополнительное обследование.
Основное внимание следует уделить соотношению АЛТ и АСТ. Обычно при жировом гепатозе АЛТ выше АСТ, однако если наблюдается перевес АСТ, это может указывать на более серьезные повреждения печени или сопутствующие заболевания. Поэтому важно учитывать не только абсолютные показатели, но и их соотношение в диагнозе.
- АлТ (аланинаминотрансфераза) и АсТ (аспартатаминотрансфераза) — ключевые ферменты, отражающие состояние печени.
- При жировом гепатозе уровень АлТ обычно повышается больше, чем уровень АсТ.
- Критическими значениями считаются: АлТ > 40-50 Ед/л, АсТ > 35-40 Ед/л.
- Увеличение уровней ферментов может указывать на более серьезные повреждения печени.
- Наблюдение и контроль этих показателей являются важными для оценки прогрессирования заболевания.
Статья опубликована в журнале: «Практика педиатра», июнь 2017 года.
М. Г. Ипатова 1, 2 к.м.н., Ю. Г.
Мухина 1 д.м.н., профессор, П. В.
Шумилов 1 д.м.н., профессор
1 Российский национальный исследовательский медицинский университет имени Н. И. Пирогова, МЗ РФ, Москва
2 Детская Городская Клиническая Больница № 13 им. Н. Ф. Филатова, Москва
В данной статье рассматриваются биохимические показатели лабораторных анализов и их клиническое значение при заболеваниях печени, проявляющихся синдромом цитолиза. Также подробно обсуждаются механизмы действия гепатопротекторов, используемых при этом синдроме.

Рис. 1. Значение печени в процессах обмена веществ.
Сокращения: ЛПВП — липопротеиды высокой плотности; ЛПОНП — липопротеиды очень низкой плотности; РЭС — ретикуло-эндотелиальная система; НАД — никотинамидадениндинуклеотид; ФАД — флавинадениндинуклеотид.
Печень является основным органом, обеспечивающим химический гомеостаз в организме, формируя общий обменный и энергетический резерв для метаболизма почти всех веществ [1]. К ключевым функциям печени относятся: метаболическая, депонирующая, барьерная, экскреторная, гомеостатическая и детоксифицирующая [2]. Она способна нейтрализовать как экзогенные токсичные вещества, так и эндогенные соединения.
Таблица 2. Причины повышения уровня аминотрансфераз
Причины, связанные с печенью
Внепеченочные причины
•Вирусные гепатиты (В, С, ЦМВ и др.)
• Хронические инфекционные и паразитарные болезни (эхинококкоз, токсоплазмоз и другие)
•Неалкогольный стеатогепатит
• Аутоиммунные состояния печени
• Чрезмерное употребление алкоголя
•Прием лекарственных препаратов(статины, некоторые антибиотики, противогрибковые препараты, нестероидныепротивовоспалительные препараты,глюкокортикостероиды, другие)
При анализе биохимических показателей крови у пациентов с жировым гепатозом печени особое внимание следует уделять уровням аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ). Эти ферменты служат маркерами повреждения печеночных клеток. В норме уровни АЛТ и АСТ не должны превышать 40 Ед/л, однако при жировом гепатозе значения могут значительно увеличиваться. Критическими считаются значения, превышающие 100 Ед/л, что может указывать на прогрессирование заболевания и возможное развитие других осложнений, таких как стеатогепатит.
Важно отметить, что соотношение АСТ/АЛТ также играет значительную роль в оценке состояния печени. При жировом гепатозе наблюдается чаще всего ассиметричное увеличение АЛТ по сравнению с АСТ. Если это соотношение превышает 2:1, это может свидетельствовать о более серьезных повреждениях печени или сопутствующих заболеваниях, таких как алкогольная болезнь. Таким образом, критическим значением соотношения АСТ/АЛТ можно считать 1, что требует дополнительного внимательного обследования пациента.
Кроме того, необходимо учитывать и другие клинические факторы, такие как симптомы, результаты ультразвукового исследования и наличие сопутствующих заболеваний. Лабораторные показатели следует интерпретировать в комплексе, чтобы правильно оценить степень поражения печени и подобрать соответствующую терапию. При уровне АЛТ и АСТ выше 100 Ед/л необходимо активно исследовать состояние печени и проводить динамическое наблюдение, чтобы своевременно выявить возможные осложнения и усилить терапевтические попытки.
• Метаболические расстройства печени (галактоземия, фруктоземия, гликогенозы, дефицит альфа-1-антитрипсина, аминокислотные расстройства, нарушение цикла мочевины, расстройства окисления жирных кислот, митохондриальная гепатопатия, некоторые лизосомные болезни (болезнь Гоше, болезнь Ниманна-Пика, дефицит кислой липазы и другие), муковисцидоз, синдром Швахмана-Даймонда, гемохроматоз, болезнь Вильсона и другие)
•врожденные и приобретенные дефектысосудов системы воротной вены (болезньБадда-Киари и др.)
• Цирроз печени
• Опухоли печени
•Патология сердца (острый инфарктмиокарда, миокардит)
• Чрезмерная физическая активность
•Наследственные нарушения мышечногометаболизма
• Приобретенные миопатии
• Травмы и некробиоз мышц
•Целиакия
• Гипертиреоз
•Тяжелые ожоги
• Гемолиз эритроцитов
• Нарушения кислотно-щелочного баланса
•Сепсис
Находясь на стыке портального и общего кровообращения, печень исполняет роль важного биофильтра. Более 70% крови поступает через воротную вену, в то время как остальная часть — через печеночную артерию. Главное количество веществ, всасывающихся в желудочно-кишечном тракте (за исключением липидов, которые в основном транспортируются через лимфатическую систему), попадает в печень по воротной вене [2]. В этом контексте печень функционирует как первичный регулятор концентрации веществ в кровотоке, поступающих с пищей (рис. 1).
Большое разнообразие функций гепатоцитов приводит к тому, что при патологических состояниях печени нарушаются биохимические константы, отражающие изменения многих видов обмена. Поэтому стандартный биохимический анализ крови включает определение различных параметров, отражающих состояние белкового, углеводного, липидного и минерального обмена, а также активность некоторых ключевых ферментов.
Уровень ферментов в клетках значительно превышает их содержание в плазме; в норме лишь небольшая доля их выявляется в крови. Наиболее распространенными причинами повышения ферментов в сыворотке являются: прямое повреждение клеточных мембран, особенно вирусами и химическими веществами, гипоксия и ишемия тканей. В некоторых случаях активность ферментов может возрасти вследствие их увеличенного синтеза в тканях. Оценка активности определенных ферментов в сыворотке крови позволяет сделать вывод о характере и степени поражения разных компонентов гепатоцитов [3, 4].
Ферменты можно разделить на несколько групп, исходя из их локализации:
1) универсально распространенные ферменты, активность которых обнаруживается не только в печени, но и в других органах – амино-трансферазы, фруктозо-1-6-дифосфатальдолаза;
2) Печеночно-специфические (органо-специфические) ферменты; их активность обнаруживается в печени более всего. К этой группе относятся холинэстераза, орнитин-карбамилтрансфераза, сорбитдегидрогеназа и другие;
3) клеточноспецифические ферменты печени относят преимущественно к гепатоцитам, купферовским клеткам или желчным канальцам (5-нуклеотидаза, аденозинтрифосфатаза);
4) Органеллоспецифические ферменты, служащие маркерами определенных органелл гепатоцита: митохондриальные (глутаматдегидрогеназа, сукцинатдегидрогеназа, цитохромоксидаза), лизосомальные (кислая фосфатаза, дезоксирибонуклеаза, рибонуклеаза), микросомальные (глюкозо-6-фосфатаза).
Специфичность ферментов и их диагностическая значимость представлены в таблице 1 [5].
Исходя из выше изложенного, следует, что в большинстве случаев отклонения активности сывороточных ферментов от «нормы» неспецифичны и могут быть вызваны различными причинами. Поэтому нужно с большой осторожностью относиться к интерпретации этих отклонений, сопоставляя их с клинической картиной заболевания и данными других лабораторных и инструментальных методов исследования [5, 6].
В клинических лабораториях применяются различные методы исследования ферментов и единицы их активности, поэтому целесообразно уточнить, каким способом и в каких единицах была произведена оценка активности фермента, и сопоставить полученное значение с «нормой», принятой в данной лаборатории.
Отдельное место занимает макроэнзиме-мия – редкое и крайне сложное для дифференциальной диагностики состояние, при котором происходит комплексирование молекул того или иного энзима с иммуноглобулинами или небелковыми веществами. Описаны клинические наблюдения макро-КФК-емии, макро-ЛДГ-емии, макро-АСТ-емии, макро-ГГТ-емии, макроамилаземии. Макро-энзимемии сложны для диагностики и дифференциальной диагностики и ведут к проведению инвазивных методов обследования и необоснованному лечению.
Определение макроэнзимемии основывается на выявлении отличий между молекулой макрофермента и обычного фермента. Некоторые методы являются прямыми, позволяя непосредственно определить наличие в крови ферментного комплекса с значительно более высокой молекулярной массой, чем нормальный фермент. Прямой метод предполагает разделение белков сыворотки по молекулярному весу. Другие методы являются непрямыми, так как выявление макроэнзима производится не за счет определения самого ферментного комплекса, а на основе выявления определенного свойства макроэнзима. Прямые тесты имеют большее диагностическое значение и требуют меньше технических и диагностических усилий.
В некоторых случаях повышенные уровни ферментов могут быть физиологическими: активность щелочной фосфатазы может повышаться у подростков в период интенсивного роста, а у здоровых женщин в третьем триместре беременности (из-за действия плаценты). Тем не менее, очень высокие уровни щелочной фосфатазы могут быть отмечены у женщин с преэклампсией, что связано с ухудшением кровоснабжения плаценты [7].
Большое значение в диагностике заболеваний печени имеют анамнестические данные и клиническая картина заболевания. Из анамнеза следует попытаться узнать о факторах риска заболеваний печени, обращая особое внимание на семейный анамнез, прием лекарств, витаминов, растительных добавок, наркотиков, алкоголя, трансфузии препаратов крови, патологические результаты печеночных проб в прошлом и симптоматику заболеваний печени. Клиническое обследование позволяет диагностировать до 50–60% патологических состояний. Более детальная дифференциальная диагностика основана на иммунохимических методах. Они позволяют детализировать характер вирусной, а также паразитарной инфекции, определить локализацию неопластического процесса, определить этиологию аутоиммунного заболевания, уточнить вид нарушения наследственных заболеваний обмена веществ.
При патологиях печени в биохимическом анализе крови выделяют четыре синдрома:
• Синдром печеночно-клеточной недостаточности
• Мезенхиально-воспалительный синдром. В этой статье мы более подробно остановимся на показателях, характерных для синдрома цитолиза.
Синдром цитолиза характеризуется нарушением проницаемости клеточных мембран, разрушением мембранных структур или некрозом гепатоцитов с выделением в плазму ферментов (АЛТ, АСТ, ЛДГ, альдолазы и другие).
АМИНОТРАНСФЕРАЗЫ: аспартатаминотрансфераза и аланинаминотрансфераза
Референсные значения: у новорожденных до 1 месяца – менее 80 Ед/л; от 2 до 12 месяцев – менее 70 Ед/л; от 1 года до 14 лет – менее 45 Ед/л; у женщин – менее 35 Ед/л, у мужчин – менее 50 Ед/л.
В клинической практике широко применяется одновременное определение уровня двух трансаминаз – аспартатаминотрансферазы (AСT) и аланинаминотрансферазы (АЛТ) в сыворотке крови.
АЛТ и АСТ находятся практически во всех клетках человеческого организма. Однако наивысшая концентрация АЛТ наблюдается в печени, что делает данный фермент специфическим маркером поражений печени. АСТ, в свою очередь, присутствует не только в печени, но и (в порядке убывания концентрации) в сердечных и скелетных мышцах, почках, поджелудочной железе, легких, лейкоцитах и эритроцитах [6, 7, 8].
АлТ находится в печени лишь в цитоплазме гепатоцитов, тогда как АСТ – как в цитоплазме, так и в митохондриях. Более 80% печеночной АСТ относится именно к митохондриальному фракционному составу [6, 7, 8].
В норме постоянство концентрации транс-аминаз в плазме крови отражает равновесие между их высвобождением вследствие физиологического апоптоза состарившихся гепатоци-тов и элиминацией. Соотношение синтеза АСТ/ АЛТ в печени равно 2,5/1. Однако при нормальном обновлении гепатоцитов уровни АСТ и АЛТ в плазме крови практически одинаковы (30–40 Ед/л) из-за более короткого периода полувыведения АСТ (18 ч против 36 ч у АЛТ).
При болезнях печени, как правило, наибольшее увеличение активности наблюдается у АЛТ по сравнению с АСТ. К примеру, в случае острого гепатита, независимо от его происхождения, уровень аминотрансфераз повышается у всех пациентов, но при этом уровень АЛТ, находящейся в цитоплазме, преобладает, так как она быстро покидает клетку и попадает в кровоток. Таким образом, уровень АЛТ отражает биохимическую активность заболевания печени. Увеличение показателя в 1,5-5 раз выше верхней границы нормы указывает на низкую активность процесса, в 6-10 раз – на умеренную и более 10 раз – на высокую биохимическую активность. Увеличение активности трансаминаз продолжительностью более 6 месяцев служит биохимическим признаком хронического гепатита [6, 7].
Некоторые лекарственные препараты (например, вальпроевая кислота) метаболизируются в митохондриях гепатоцитов [9], поэтому ранним лабораторным маркером гепатотоксичности может быть лишь изолированное повышение АСТ.
Помимо заболеваний печени, АСТ является одним из первых маркеров повреждения сердечной мышцы (повышается у 93-98% пациентов с инфарктом миокарда до 2–20 раз от нормы); его специфичность невысока. Уровень АСТ в сыворотке крови начинает повышаться через 6–8 часов после начала болевого приступа, достигая пика через 18–24 часа, а активность снижается до нормальных значений на 4-5 день. Увеличение активности фермента в динамике может свидетельствовать о расширении зоны некроза и вовлечении в патологический процесс других органов и тканей, таких как печень [7].
Интенсивные физические тренировки с избыточными нагрузками могут также привести к временному повышению уровня АСТ в сыворотке. Миопатии, дерматомиозиты и другие заболевания мышечной ткани часто вызывают увеличение трансаминаз, в основном за счет АСТ.
Умеренное увеличение активности АСТ (в 2–5 раз от верхней границы нормы) отмечается при острых панкреатитах и гемолитических анемиях.
При латентных формах цирроза печени, как правило, наблюдается отсутствие повышения активности ферментов. В активных формах цирроза стойкое незначительное повышение аминотрансфераз наблюдается в 74–77% случаев, и, как правило, активность АСТ превышает АЛТ в два и более раз.
Снижение активности АЛТ и АСТ имеет место при недостаточности пиридоксина (витамина В6), при почечной недостаточности, беременности.
В таблице 2 представлены как печеночные, так и внепеченочные причины, приводящие к увеличению активности аминотрансфераз в сыворотке крови.
В клинической практике диагностика заболеваний печени и сердца включает определение коэффициента де Ритиса – это соотношение между уровнями АСТ и АЛТ (АСТ/АЛТ). Рекомендуемое значение этого показателя колеблется от 0,8 до 1,33. Важно подчеркнуть, что вычисление коэффициента де Ритиса следует проводить только при значительном превышении референтных значений АСТ и/или АЛТ.
У новорожденных детей соотношение АСТ/АЛТ обычно превышает 3,0, однако к пятому дню жизни снижается до 2,0 и ниже.
При заболеваниях печени, сопровождающихся разрушением гепатоцитов, наблюдается увеличение уровня АЛТ, в то время как коэффициент де Ритиса может снижаться до 0,2–0,5. В случае заболеваний сердца уровень АСТ обычно выше, что приводит к увеличению данного коэффициента. Тем не менее, для более точной дифференциации заболеваний этот коэффициент может быть недостоверен, так как в ситуации алкогольного поражения печени, неалкогольного стеатогепатита и цирроза также наблюдается преобладание АСТ, и значение коэффициента де Ритиса может достигать 2,0 и больше. Превышение нормы данного коэффициента также часто фиксируется при обструкция желчными путями и холецистите, даже если абсолютные значения АЛТ и АСТ относительно невысоки.
1. При остром вирусном и хроническом гепатитах, особенно на ранних стадиях, активность АЛТ выше, чем АСТ (коэффициент де Ритиса меньше 1,0). Тяжелое поражение паренхимы печени может изменить это соотношение.
2. В случае алкогольного гепатита и цирроза значение АСТ может превышать уровень АЛТ (коэффициент де Ритиса выше 1,0).
3. При остром инфаркте миокарда а также наблюдается преобладание АСТ над АЛТ (коэффициент де Ритиса свыше 1,5).
ЛАКТАТДЕГИДРОГЕНАЗА
Рекомендуемые пределы активности ЛДГ для новорожденных не должны превышать 600 Ед/л. У детей в возрасте от 1 до 12 лет активность ЛДГ составляет 115–300 Ед/л, а для подростков старше 12 и взрослых – до 230 Ед/л.
Лактатдегидрогеназа (ЛДГ) – гликолитический цинксодержащий фермент, обратимо катализирующий окисление L-лактата в пируват, широко распространен в организме человека. Наибольшая активность ЛДГ обнаружена в почках, сердечной мышце, скелетной мускулатуре и печени. ЛДГ содержится не только в сыворотке, но и в значительном количестве в эритроцитах, поэтому сыворотка для исследования должна быть без следов гемолиза [7].
Исследования с использованием электрофореза или хроматографии позволяют выделить 5 изоферментов ЛДГ, которые различаются по своим физико-химическим свойствам. Наибольшее клиническое значение имеют два из них – ЛДГ1 и ЛДГ5. ЛДГ1 наиболее активно катализирует восстановление лактата в пируват и преимущественно находится в сердечных тканях, а В ряде других тканей, которые функционируют в условиях аэробного дыхания. Поэтому клетки миокарда, имея развитую митохондриальную систему, могут окислять как пируват, так и лактат, продуцируемый различными тканями в ходе метаболических процессов.
Фракция ЛДГ5 более эффективно катализирует прямую реакцию восстановления пирувата в лактат. Она локализуется преимущественно в печени, в скелетных мышцах. Последние нередко вынуждены функционировать в анаэробных условиях (при значительной физической нагрузке и быстро наступающем утомлении). Образующийся при этом лактат с кровотоком попадает в печень, в которой он используется для процесса глюконеогенеза (ресинтеза глюкозы), а В сердце и другие ткани, где происходит его преобразование в пируват и вовлечение в цикл трикарбоновых кислот (цикл Кребса). Любое повреждение клеток тканей, содержащих большое количество ЛДГ (сердце, скелетные мышцы, печень, эритроциты), приводит к повышению активности ЛДГ и ее изо-ферментов в сыворотке крови. Наиболее частыми причинами повышения активности ЛДГ являются:
1. Заболевания сердца (острый инфаркт миокарда, миокардит, застойная сердечная недостаточность); в таких случаях чаще наблюдается увеличение активности ЛДГ1 и/или ЛДГ2.
2. Поражение печени (острые и хронические гепатиты, цирроз печени, опухоли и метастазы печени), когда преимущественно увеличивается изофермент ЛДГ5, ЛДГ2, ЛДГ4.
3. Поражения скелетных мышц, воспалительные и дегенеративные болезни скелетных мышц (в основном наблюдается увеличение уровней ЛДГ1, ЛДГ2 и ЛДГ3).
4. Заболевания крови, принимающие участие в разрушении ее клеток: острый лейкоз, гемолитическая анемия, анемия из-за дефицита В12, серповидно-клеточная анемия, а также состояния, сопровождающиеся разрушением тромбоцитов (например, массивные гемотрансфузии, тромбоэмболия легочной артерии, шок и т.д.). При этих условиях может отмечаться увеличение активности ЛДГ2 и ЛДГ3.
5. Острый панкреатит.
6. Заболевания легких (например, пневмония и прочие).
7. Инфаркт почки.
8. Онкологические заболевания (уровень ЛДГ повышается в 27% случаев на I стадии опухолей и в 55% – при метастатических семиномах).
Важно помнить, что различные заболевания сердца, скелетных мышц, печени и крови могут приводить к повышению активности общей ЛДГ в сыворотке крови, не демонстрируя отчётливого преобладания какого-либо из ее изоферментов.
Таблица 3. Эффективность гепатопротекторов при синдроме цитолиза (по С. В. Морозову с соавт., 2011 г. и Н.
(Б. Губергриц, 2012 г.) [10]
Препараты
Синдром цитолиза
Стадии жирового гепатоза
Существует 4 степени жирового гепатоза:
0 степень – в отдельных группах печеночных клеток содержатся мелкие частички жира;
I степень — в клетках наблюдается увеличение размера жировых капель и формируются отдельные участки сыра, пораженных клеток (33% поврежденных гепатоцитов на едином срезе);
II степень – капли жира разных размеров содержатся в 33–66% клеток печени (мелкокапельное, среднекапельное, крупнокапельное внутриклеточное ожирение);
III степень — жир выходит за пределы клеток, образуя внеклеточные жировые образования, такие как кисты (диффузное крупнокапельное ожирение с внеклеточной локализацией), более 66% поврежденных гепатоцитов на едином срезе.
Причины жирового гепатоза
Основной причиной жирового гепатоза является метаболический синдром — нарушение обмена веществ и гормональные изменения, которые часто приводят к развитию сахарного диабета и повышенному уровню липидов в крови, увеличивая риск сердечно-сосудистых заболеваний.
К жировому гепатозу может приводить:
- злоупотребление спиртными напитками,
- избыточный вес,
- определенные вирусные инфекции (вирусы гепатита В и С),
- нарушение режима питания,
- метаболические расстройства при сахарном диабете,
- повышение активности печеночных ферментов (АЛТ, АСТ, ГГТ),
- упадочные дефекты в цикле мочевины и окислении жирных кислот,
- наследственные факторы,
- некоторые медикаменты, например, нестероидные противовоспалительные препараты.
Метаболический синдром — причина жировой болезни печени
Наиболее распространенной причиной обструкции печени считают метаболический синдром, именуемый также «синдромом X». Его проявления следующие:
- абдоминальное ожирение (у женщин это окружность талии более 80 см, у мужчин – более 94 см);
- повышение уровня триглицеридов (выше 150 мг/дл);
- снижение уровня холестерина ЛПВП или хорошего холестерина (менее 50 мг/дл для женщин и менее 40 мг/дл для мужчин);
- повышение артериального давления (систолическое выше 130 мм рт. ст. или диастолическое выше 85 мм рт. ст.);
- увеличение уровня глюкозы в крови (натощак выше 100 мг/дл).
В настоящее время метаболический синдром в России, и в то же время повышенный риск ожирения печени, обнаруживается более чем у 20% пациентов.
Что еще вызывает ожирение печени
К числу причин жирового гепатоза относятся:
- метаболические расстройства,
- употребление наркотиков,
- влияние токсинов,
- инфекционные агенты.
В группу метаболических расстройств, которые могут вызывать дисфункцию печени, входят ожирение, резкая потеря массы тела после операций (например, при лечении ожирения), а также определенные заболевания или голодание.
Повышенный риск развития ожирения печени встречается у людей с сахарным диабетом 2 типа, однако у пациентов с сахарным диабетом 1 типа этот риск не увеличивается.
Среди заболеваний, способствующих метаболическим расстройствам и приводящих к симптомам жирового гепатоза, можно отметить целиакию, болезнь Крона, язвенный колит, рак поджелудочной железы, острый и хронический панкреатиты, рак желудочно-кишечного тракта, где пациенты нуждаются в парентеральном питании, что не будет усугублять генетические заболевания, способствующие накоплению жиров в организме.
Жировая инфильтрация печени наблюдается у пациентов, принимающих препараты, такие как: метотрексатом, салицилаты, амиодарон, дилтиазем, глюкокортикоиды, а так же большие дозы витамина А. Меньше жировой дистрофии печени является антибиотик (например. Тетрациклин). Стеатоз печени также наблюдается у людей, страдающих гепатитом, вызванным вирусами C и D.
Факторы риска и этиология
Метаболический синдром (МС) и сахарный диабет 2 типа (СД2). Неалкогольная жировая болезнь печени (НАЖБП) ассоциируется с компонентами МС, представляя собой совокупность факторов риска, предрасполагающих к развитию СД2 и сердечно-сосудистых заболеваний [2].
Критерии диагностики МС следующие:
— окружность талии более 94 см у мужчин и более 80 см у женщин европеоидной расы;
— артериальное давление выше 130/85 мм рт. ст. или использование антигипертензивных средств;
— уровень глюкозы натощак более 100 мг/дл (5,6 ммоль/л) или прием антидиабетических препаратов;
— уровень триглицеридов в сыворотке превышает 150 мг/дл (больше 1,7 ммоль/л);
— уровень холестерина ЛПВП менее 40 мг/дл у мужчин и менее 50 мг/дл у женщин (менее 1,0—1,3 ммоль/л).
Существующие диагностические критерии требуют наличия трех из пяти перечисленных факторов [3].
Пациенты с СД2 чаще имеют тенденцию к накоплению жира в печени независимо от наличия ожирения, обычно у них выявляется инсулинорезистентность и дислипидемия, и они часто страдают от ожирения [11—13], что увеличивает риск НАЖБП. Кроме того, риск осложнений, связанных с неалкогольной жировой болезнью печени (НАСГ), у пациентов с СД2 повышен в 2–4 раза [14, 15].
НАЖБП наиболее распространена среди лиц с риском развития СД2, т. е. при уровне гликированного гемоглобина (HbA1с) 5,7—6,4% (38,8—46,4 ммоль/моль), уровне глюкозы натощак 5,55—6,94 ммоль/л и/или нарушении толерантности к глюкозе (НТГ), т. е. уровень глюкозы 7,77—11,04 ммоль/л через 2 ч после перорального глюкозотолерантного теста (ПГТТ) с 75 г глюкозы. Как СД2, так и повышенный риск СД тесно связаны с тяжестью НАЖБП и способствуют развитию НАСГ, выраженного фиброза и ГЦК [16, 17].
Инсулинотерапия может привести к накоплению жира в теле, но не способствует возникновению или усугублению НАЖБП при сахарном диабете [18, 19].
Этнические различия. Согласно исследованию, проведенному в США, максимальная распространенность НАЖБП наблюдается среди испаноязычного населения [13]. Среди американцев азиатского происхождения зафиксирован резкий рост частоты НАЖБП, и интересно, что этот диагноз нередко ставят людям с нормальным индексом массы тела (ИМТ) [20].
Было также показано, что стеатоз у афроамериканцев с НАЖБП был выражен значительно меньше, чем у «белых» пациентов. Кроме того, афроамериканцы имели меньший риск развития печеночной недостаточности, чем представители других этнических групп. Установлено, что часть этих национальных различий в эпидемиологии НАЖБП основаны на генетических особенностях [21, 22].
Пол и возраст. Данные научных работ о влиянии пола на развитие НАЖБП зачастую противоречивы. Некоторые исследования показывают большую распространенность заболевания среди мужчин, в то время как другие указывают на обратное. По данным эпидемиологического исследования, проведенного А. Lonardo и его коллегами [14], НАЖБП чаще встречается у мужчин, причем его распространенность увеличивается с возрастом (от молодых до средних лет), а затем, начиная с 50-60 лет, снижается. У женщин наблюдается редкость заболевания до менопаузы, после 50 лет, наоборот, заболеваемость начинает увеличиваться, достигая пика в 60-69 лет.
Сообщалось, что распространенность НАЖБП увеличивается с возрастом: у лиц моложе 20 лет — 20%, старше 60 лет — 40% [24]. Наряду с ростом распространенности с увеличением возраста, у лиц в возрасте 50 лет и старше распространенность НАСГ и ЦП также увеличивается по сравнению с людьми более молодого возраста.
Питание, характерное для западных стран, с высоким содержанием красного мяса, рафинированных углеводов и сладких напитков, ассоциируется с повышенным риском формирования метаболического синдрома и НАЖБП [22].
В ретроспективном исследовании с участием 2029 человек было установлено, что курение сигарет выступает независимым фактором риска для НАЖБП [27]. Более того, применение табака может способствовать возникновению инсулинорезистентности [28—30]. Исследование, проведенное среди американских подростков, показало, что как активное, так и пассивное курение является независимым предиктором развития метаболического синдрома [31].
Что касается образа жизни, то риск НАЖБП и НАСГ зависит от физической активности, уровня физического состояния и малоподвижного образа жизни; тяжесть течения НАЖБП увеличивается при снижении физической активности [22]. В систематическом обзоре [32] было показано, что положительное влияние на клинические проявления НАЖБП оказывают не только аэробные упражнения, такие как бег, но и силовые упражнения, которые могут быть более приемлемыми для больных с НАЖБП с плохой кардиореспираторной выносливостью, т. е. неспособных переносить аэробную нагрузку.
Синдром поликистозных яичников (СПКЯ) представляет собой широко распространенное эндокринное расстройство у женщин в репродуктивном возрасте, которое зачастую связано с избыточной массой тела и инсулинорезистентностью. Эти факторы в свою очередь увеличивают риск развития второго типа сахарного диабета у пациенток, страдающих СПКЯ [33]. Кроме того, у женщин с данным синдромом наблюдается повышенная продукция андрогенов, что нередко приводит к инсулинорезистентности. В результате распространенность неалкогольной жировой болезни печени (НАЖБП) среди женщин с СПКЯ значительно выше, чем в общей популяции. Например, в исследовании, в котором участвовало 600 женщин со СПКЯ и 125 здоровых женщин с сопоставимыми индексами массы тела, была отмечена большая распространенность НАЖБП в группе с синдромом [34]. Связь между СПКЯ и НАЖБП была подтверждена в ряде исследований [35—37].
Синдром обструктивного апноэ сна (СОАС). За последние годы появилось множество подтверждений взаимосвязи СОАС, СД2, МС и сердечно-сосудистых заболеваний [38]. В исследовании F. Tanne и соавт. [37] было установлено, что для пациентов с тяжелой СОАС характерны более выраженная инсулинорезистентность, а также более распространенный стеатоз в печени, более выраженный некроз и фиброз (при биопсии печени) по сравнению с пациентами без СОАС при сопоставимом ИМТ. Считается, что патогенетические механизмы, лежащие в основе этой ассоциации, связаны с хронической прерывистой гипоксией, приводящей к увеличению уровней провоспалительных цитокинов, эндотелиальной дисфункции, окислительному стрессу, нарушению обмена веществ, и, в конечном итоге, к инсулинорезистентности [39—42].
Генетические аспекты. В настоящее время установлено несколько генетических предрасполагающих факторов, которые влияют на возникновение и развитие НАЖБП [43]. В 2007 году впервые была выявлена связь между НАЖБП и геном PNPLA3 с использованием полногеномного анализа ассоциаций [12]. Данная взаимосвязь впоследствии была подтверждена в когортах пациентов из Японии, Индии и Китая, страдающих НАЖБП [43—45].
В метаанализе A. Singal и соавт. [46], который охватывает 24 исследования с участием 9915 пациентов, было показано, что существует ассоциация между геном PNPLA3 и тяжестью фиброза. Ген TM6SF2 также считается модификатором НАЖБП [47—50] и его определение может быть полезным в клинической практике.
Патогенез
В основе патогенеза НАЖБП лежат инсулинорезистентность и гиперинсулинемия, которые приводят к выраженным нарушениям липидного, углеводного обменов, дисбалансу между потреблением и утилизацией липидов. Вследствие повышенного поступления в печень свободных жирных кислот, снижения скорости их окисления в митохондриях и снижения синтеза липопротеидов очень низкой плотности (ЛПОНП) происходит накопление жира в клетках печени. Это приводит к нарушению утилизации триглицеридов, а их избыток откладывается в виде жировых вакуолей в гепатоцитах, что обусловливает формирование жировой инфильтрации печени — стеатоза [1]. Трансформации стеатоза в стеатогепатит происходят в результате повышения продукции жировой тканью фактора некроза опухоли α, увеличения концентрации свободных жирных кислот, активации цитохрома Р450 и перекисного окисления липидов, а также накопления свободнорадикальных форм кислорода.
Как правило, НАЖБП протекает бессимптомно и частенько диагностируется случайно во время обследований по другим поводам. Чаще всего данное заболевание обнаруживается, когда пациенты обращаются к специалистам по поводу артериальной гипертензии, ишемической болезни сердца, заболеваний периферических сосудов, ожирения и сахарного диабета второго типа. У таких больных НАЖБП можно заподозрить, если наблюдаются признаки цитолиза и/или гепатомегалии.
В клинической картине на первый план могут выходить симптомы, характерные для МС: висцеральное ожирение, признаки нарушения обмена глюкозы, дислипидемия и артериальная гипертензия. Часть пациентов предъявляют неспецифические жалобы на повышенную утомляемость, ноющую боль или дискомфорт в области правого подреберья без четкой связи с приемом пищи.
Если же НАЖБП приводит к циррозу печени, у пациента могут возникнуть симптомы, ассоциирующиеся с печеночной недостаточностью или портальной гипертензией, такие как увеличение живота, отеки, геморрагический синдром, а также энцефалопатия и т.д. [51, 52].
При случайном выявлении стеатоза необходимо тщательно изучить семейный и личный анамнез, исключая вторичные причины стеатоза. Обследование должно включать детальную оценку всех компонентов метаболического синдрома. Если у пациента наблюдается ожирение, сахарный диабет второго типа и случайно выявленные повышенные уровни печеночных ферментов на фоне метаболических факторов риска, следует провести дополнительное обследование для выявления стеатоза, неалкогольной жировой болезни печени и фиброза.
Комплексная оценка пациентов с подозрением на НАЖБП [5].
1. Первичное обследование:
— употребление алкоголя (о неалкогольном генезе свидетельствует употребление менее 20 г этанола в сутки женщинами и менее 30 г/сут мужчинами);
— изучение личного и семейного анамнеза на предмет сахарного диабета, артериальной гипертензии и сердечно-сосудистых заболеваний;
— измерение индекса массы тела, окружности талии и изменение массы тела;
— инфекция, вызванная вирусами гепатитов В и С;
— наличие в анамнезе приема препаратов, способствующих стеатозу;
— печеночные ферменты — аспартат- (АСТ) и аланинаминотрансфераза (АЛТ), γ-глутамилтранспептидаза (ГГТ);
— уровень глюкозы натощак, HbA1c, пероральный глюкозотолерантный тест, уровень инсулина натощак (HOMA-IR);
— общий анализ крови;
— уровень общего ХС, ЛПВП, триацилглицерола, мочевой кислоты в сыворотке;
— ультразвуковое исследование (при повышенных уровнях печеночных ферментов).
2. Расширенное обследование:
— ферритин и насыщение трансферрина;
— обследование на целиакию, заболевания щитовидной железы и синдром поликистозных яичников;
— обследование на редкие заболевания печени (болезнь Вильсона—Коновалова, аутоиммунный гепатит, дефицит α1-антитрипсина).
Для определения степени выраженности стеатоза, некровоспалительных изменений и стадии фиброза печени у пациентов с НАЖБП применяются различные расчетные тесты (FibroTest, Fatty Liver Index, SteatoTest, NAFLD Liver Fat score и др.). С помощью этих тестов осуществляется расчет соответствующего индекса на основании ряда показателей путем математического анализа.
Например, в шкале оценки содержания жира в печени при НАЖБП (NAFLD Liver Fat score) [53] для расчета используют данные о наличии или отсутствии метаболического синдрома, СД2, уровне инсулина сыворотки крови натощак, АСТ и АЛТ. Этот показатель может быть рассчитан с помощью представленного в интернете калькулятора: https://www.mdapp.co/non-alcoholic-fatty-liver-disease-liver-fat-score-nafld-lfs-calculator-358/
Среди неинвазивных методов диагностики НАЖБП Выделяется транзиентная эластография (фибросканирование, фиброэластометрия), которая позволяет определить эластичность печеночной ткани с использованием аппарата FibroScan. Максимальная диагностическая точность этого метода достигается при выраженных стадиях фиброза. Однако существуют недостатки, такие как неспособность оценить степень выраженности некровоспалительного процесса, невысокая информативность для пациентов с избыточной массой тела и невозможность беспристрастно оценить состояние печени на стадии стеатоза, стеатогепатита и ранних стадиях фиброза.
При обнаружении значительного фиброза окончательный диагноз устанавливается с помощью печеночной биопсии.

Биопсия печени — это «золотой стандарт» диагностики НАЖБП, позволяющий с высокой степенью достоверности подтвердить наличие стеатоза и воспаления, определить стадию фиброза, а также провести дифференциальный диагноз между стеатозом и НАСГ, исключить другие причины поражения печени и прогнозировать дальнейшее течение заболевания. Диагностический алгоритм оценки пациентов с подозрением на НАЖБП представлен на рисунке.
Как узнать есть ли ожирение печени?

В последние годы вопрос жировой болезни печени становится все более актуальным. Число пациентов с данной проблемой растет, и всё чаще они обращаются к гепатологам и гастроэнтерологам с вопросами: «Что это такое? Как с этим справиться?»

В общей популяции жировой гепатоз встречается у 3-40 % населения, в зависимости от региона. У больных ХВГС эта проблема встречается чаще достоверно чаще- от 30 до 70%. Стеатоз (жировой гепатоз) — не просто жирная печень, а проявления нарушения метаболических процессов в организме. Жировой называют печень, более 5% массы которой составляет жир, преимущественно в виде триглицеридов. Жировая дистрофия печени развивается при нарушении жирового обмена, обусловленного либо дефектом гепатоцитов, либо чрезмерным поступлением в них жиров, жирных кислот или углеводов, превышающим способность гепатоцитов к секреции липидов.
Выделяют три степени жирового гепатоза:
- 1 степень – количество жировой ткани в печени составляет от 5 до 30%;
- 2 степень – замещение от 30 до 60% печеночной ткани жировой;
- 3 степень – более 60% поражения печени.
Фиброз характеризуется гибелью клеток печени (гепатоцитов) и образованием соединительной ткани на месте здоровых клеток. Существует 4 степени фиброза, где 4 степень соответствует циррозу.
Зачастую эти 2 процесса сочетаются и вместе мешают печени адекватно выполнять свои функции. Наличие одного жирового гепатоза со временем может стать причиной цирротических изменений в печени.
Как диагностировать данные процессы?
Как правило, пациенты начинают замечать вялость, дискомфорт и тяжесть в правом подреберье, а при проведении анализа крови выявляются повышенные уровни трансаминаз (ферментов печени АЛТ и АСТ). Тем не менее, бывают случаи, когда изменения в печени выявляются случайно без наличия каких-либо жалоб.
Изменения печени можно обнаружить при скрининговом УЗИ, калькуляции функций печени по изменениям в крови, с помощью эластографии. Это метод определения эластичности (жесткости) печени и основан он на свойствах патологических процессов менять жесткость ткани и по другому отражать ультразвуковые волны. Стеатоз с включением как минимум 10 % гепатоцитов, может быть зарегистрирован с помощью системы CAP (Controlled Attenuation Parameter = Параметр контролируемого затухания) – неинвазивный метод оценки и количественного определения стеатоза, выражается в децибелах на метр (дБ/м) и является величиной затухания ультразвука, которая соответствует уменьшению амплитуды ультразвуковых волн при их распространении через ткань печени. Ранее для определения характера и степени изменений печени проводилась только биопсия печени — «золотой стандарт» в диагностики заболеваний печени. В настоящее время в большинстве случаев это исследование можно заменить эластографией печени-неинвазивный метод, позволяющий оценить степень жесткости печени и таким образом, определить тяжесть функциональных дефектов.
Эластография или эластометрия может выполняться с применением аппарата фиброскан, который позволяет определить степень стеатоза, или с использованием аппарата УЗИ с добавленной функцией «эластография». Это дает ряд преимуществ, так как позволяет оценить печень в совокупности, произвести измерения и оценить кровоток, в то время как фиброскан выполняет локальные измерения. В результате обоих методов можно установить степень фиброза.
Лечением заболеваний печени занимаются гепатологи и гастроэнтерологи. Интерпретация данных о жесткости печени должна учитывать другие клинические и лабораторные сведения. Рекомендуется проконсультироваться с врачом, чтобы вовремя выявить изменения в организме и принять соответствующие меры. Часто изменения в печени обратимы, так как этот орган является одним из немногих, способных к регенерации при надлежащем медицинском вмешательстве.
КАК РАЗОГНАТЬ ЗАСТОЙ ЖЕЛЧИ
— Карима Ташхановна, еще одна распространенная проблема современности — застой желчи. Что лучше принимать при застое желчи?
— Наилучшим желчегонным средством служит правильное питание. Когда человек регулярно принимает пищу и не сталкивается с механическими препятствиями для оттока желчи (например, изгибами или камнями), это является самым эффективным желчегонным средством. Здоровый желчный пузырь реагирует на поступление пищи сжатиями и выбросом желчи.
При любых заболеваниях ЖКТ категорически нельзя есть холодное, кислое и острое, потому что такая еда вызывает спазм сфинктера Одди и в результате — нарушение оттока желчи.
В настоящее время наблюдается высокое число случаев деформации желчного пузыря и его протоков, вплоть до того, что желчный пузырь порой принимает форму подковы. Такие деформации могут затруднять отток желчи. В таких случаях я рекомендую заниматься дыхательной гимнастикой для укрепления мышц пресса.
Если у пациента обнаружена деформация желчного пузыря или его протоков, то первым делом нужно провести УЗИ. Для диагностики я использую УЗИ желчного пузыря с пищевой нагрузкой, что дает важную информацию о том, как и когда сокращается желчный пузырь. Существует гипертонический желчный пузырь, при котором желчь выбрасывается очень быстро, а также гипотонический, когда отток замедленный.
УЗИ ЖЕЛЧНОГО ПУЗЫРЯ С ПИЩЕВОЙ НАГРУЗКОЙ
— УЗИ желчного пузыря с пищевой нагрузкой проводится натощак. Сначала врачи смотрят на УЗИ первоначальную картину. Затем пациент съедает завтрак, это могут быть 2 вареных яйца, или достаточно жирный йогурт. Минут через 15 мы смотрим первый выброс желчи. В норме первая порция желчи должна быть в районе 40%.
У наших пациентов желчь выделяется с задержкой: всего 10% за первые 15 минут, затем через 15 минут еще 30%, что свидетельствует о полном желчном пузыре, который опорожняется медленно. В таких случаях врачи должны сосредоточиться на том, чтобы обеспечить своевременное опорожнение желчного пузыря и повысить его тонус.
Важно!
Материалы, размещенные на сайте TopDoc.me, не предназначены для самодиагностики и самолечения. Если у вас есть какие-либо заболевания или вас беспокоят симптомы, обязательно обратитесь к вашему врачу. Информация на сайте TopDoc.me не заменяет личную консультацию врача и предназначена исключительно для справочных целей.
Читайте отзывы, задавайте вопросы и записывайтесь на прием к доктору Таировой К.Т. любым из удобных для вас способов:
- оставить заявку на сайте;
- написать нам в WhatsApp — наши консультанты обязательно ответят или перезвонят;
- позвонить по номеру +7 (707) 22 55 009.