Средняя скорость 1,9 м/с в тканях печени, определенная с помощью УЗИ с эластографией, указывает на уровень жесткости печени. Это значение может свидетельствовать о наличии фиброза или цирроза, поскольку увеличение жесткости тканей чаще всего связано с патологическими состояниями печени.
Эластография является важным инструментом для диагностики заболеваний печени, так как позволяет оценить степень повреждений и прогрессирование болезни. Значение 1,9 м/с может требовать дальнейших исследований и оценки состояния печени для выбора оптимальной тактики лечения.
- Определение средней скорости: Средняя скорость 1.9 м/с на УЗИ с эластографией указывает на уровень жесткости печеночной ткани.
- Здоровье печени: Нормальные значения скорости могут варьироваться, и 1.9 м/с может свидетельствовать о стадии заболевания печени.
- Эластография: Методика помогает оценить состояние ткани печени, выявляя фиброз и цирроз.
- Клиническое значение: Повышенная жесткость может указывать на глубокие патологии, требующие дальнейшего обследования.
- Сравнительный анализ: Результаты следует интерпретировать в контексте клинической картины и других лабораторных данных.
Анализ очаговых образований в печени является значимой частью медицинских расходов, существенно влияя на подход к лечению пациентов как с точки зрения здоровья, так и диагностики заболеваний. Метастатический рак печени занимает ведущее положение среди злокачественных опухолей данного органа, и лица с запущенными формами рака легких, молочной железы и толстой кишки подвергаются повышенному риску появления этих образований. Поэтому регулярный мониторинг состояния печени становится стандартом помощи после диагностики и терапии первичных опухолей.
Первичный рак печени занимает пятое место в мировом рейтинге по распространенности, и его диагностика и лечение требуют высокой точности визуальных исследований. Регулярное наблюдение за группами риска играет ключевую роль в раннем выявлении опухолей, что важно для успешного лечения на ранних стадиях. Однако помимо задач, связанных с обнаружением потенциально злокачественных образований, стоит учитывать и распространенность доброкачественных опухолей и опухолевидных образований в печени. Несмотря на наличие характерных признаков на ультразвуковом исследовании, для окончательной диагностики часто требуются дополнительные исследования, чтобы избежать путаницы с злокачественными образованиями и не пропустить действительно серьезные заболевания. По этой причине многие образования, обнаруженные случайно, требуют дальнейшего углубленного обследования с использованием методов, таких как магнитно-резонансная или компьютерная томография, а также контрастное УЗИ.
На протяжении истории диагностика опухолей печени осуществлялась либо хирургическим путем, либо посредством биопсии. Тем не менее, в последние 40 лет наблюдается явная тенденция перехода к менее инвазивным методам диагностики. Мы находимся в эпоху неинвазивных технологий, которая была достигнута благодаря использованию методов визуализации с контрастом, таких как компьютерная и магнитно-резонансная томография, а также, совсем недавно, ультразвукового исследования. Эти методики показывают отличные результаты, и только незначительная доля образований печени нуждается в биопсическом подтверждении.
Средняя скорость в тканях печени, равная 1,9 м/c, может иметь несколько интерпретаций при проведении ультразвукового исследования с эластографией. Во-первых, этот показатель позволяет оценить жесткость печени, что является важным критерием для диагностики и мониторинга заболеваний этого органа. Увеличенная жесткость может указывать на наличие фиброза или цирроза, что требует дальнейшего клинического анализа и наблюдения.
Кроме того, значение средней скорости также может помочь определить степень воспалительного процесса или жировой дистрофии, что немаловажно для выбора стратегии лечения. Например, при наличии сопутствующих заболеваний, таких как гепатит или стеатоз, рост жесткости может быть более выраженным, что указывает на серьезность состояния печени и необходимость более тщательной диагностики.
Важно отметить, что интерпретация результатов эластографии требует комплексного подхода. Я считаю, что необходимо учитывать не только среднюю скорость, но и сопутствующие клинические данные, такие как лабораторные показатели, истории болезни пациента и другие результаты визуализации, чтобы прийти к наиболее точному диагнозу и эффективному плану лечения.
Важна неинвазивная оценка образований печени, поскольку часто встречаются доброкачественные и незначительные образования. Гемангиома, наиболее распространенная доброкачественная опухоль печени, например, присутствует у 20% пациентов при аутопсии. 4,5 Их часто выявляют в эпоху поперечного сечения, когда они часто обнаруживаются как случайная находка при КТ, МРТ или УЗИ, выполняемых по несвязанным причинам. Неинвазивное подтверждение их доброкачественной природы позволяет исключить их из рассмотрения при клиническом лечении и позволяет избежать ненужной болезненной биопсии и беспокойства.
3 Эластография для диагностики опухолей печени
Эластография, представляющая собой новый неинвазивный метод визуализации, позволяет оценить естественные свойства тканей восстанавливаться после воздействия различных деформаций. Этот подход эффективно используется для диагностики диффузных заболеваний печени и определения степени фиброза, который может перейти в цирроз.
Она также зарекомендовала себя как метод дифференциации твердых злокачественных опухолей молочной железы от более мягких и, скорее всего, доброкачественных. Известно, что опухоли, как правило, во много раз более жесткие, чем окружающие их ткани, независимо от органа происхождения, из-за чего их реакция на деформацию сильно различается.
При механическом воздействии опухоли деформируются в меньшей степени, чем окружающие их ткани. Сравнивая цирротическую печень, обладающую большей жесткостью, с опухолью, можно заметить, что разница в жесткости может быть достаточно значительной. Опухоль, являющаяся твердой относительно здоровой печени, может оказаться мягче, чем ткани печени при циррозе. В этом контексте мы рассматриваем применение эластографии для диагностики очаговых образований печени и их дифференциации от злокачественных опухолей.
В научной литературе описаны различные методы эластографии, однако наибольшее внимание заслуживают три из них: точечная эластография сдвиговой волной (p-SWE), двумерная эластография сдвиговой волной (2D-SWE) и эластография деформации (SE). Каждый из этих методов применяется по-своему, и тканевая реакция на них отличается, хотя основываются они на схожих научных принципах.
.1 Эластография сдвиговой волной
Временная эластография
Временная эластография (ТЭ), известная также как FibroScan (Echosens, Экс-ан-Прованс, Франция), использует ультразвуковой преобразователь, установленный на конце вибрирующего поршня для создания низкоамперного вибрационного сигнала. Датчик устанавливается без визуального контроля на кожную поверхность, и вибрационная волна проникает в печень на глубину около 6 см. Скорость обратного импульса отражает жесткость ткани: чем выше скорость, тем жестче ткань. Эта техника, не требующая визуализации местоположения, хорошо подходит для оценки состояния крупных органов, таких как печень, и может также использоваться для измерения жесткости пальпируемых образований, как в случае ткани молочной железы. Однако образования в печени, как правило, не пальпируются, так как располагаются глубоко за реберной дугой, что делает ТЭ менее приемлемым вариантом для данной области.
Точечная эластография сдвиговой волной
При точечной эластографии сдвиговой волной применяется метод акустического излучения (ARFI), который был недавно внедрен в стандартные ультразвуковые аппараты (Acuson S2000, Siemens Medical Solutions, Маунтин-Вью, Калифорния) и в Philips EPIQ (Philips, Ботель, Вашингтон). В отличие от ТЭ, при ARFI создается упругая сдвиговая волна благодаря ручному давлению на поверхность органа. В интересующей области акустический импульс генерируется зондом, во время чего визуализация происходит в режиме реального времени. Как и в случае с ТЭ, более высокие скорости поперечных волн указывают на жесткие ткани. ARFI использует высокоэнергетические сжатые акустические импульсы, что позволяет достичь точных результатов.
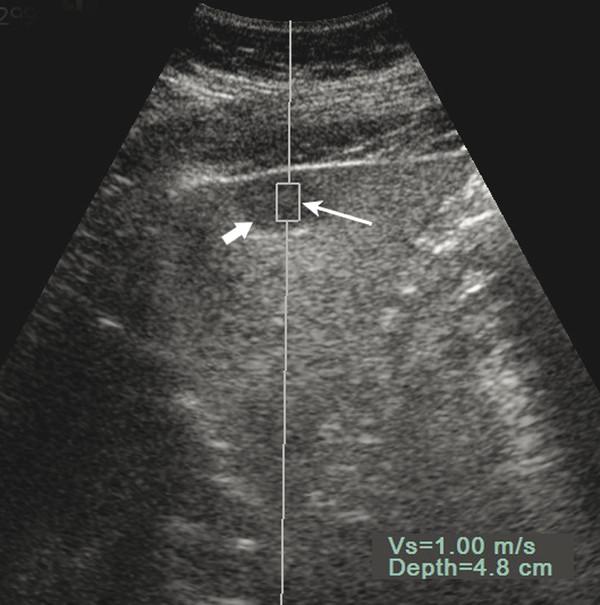
Рис. 4.1 Метод силового импульсного акустического излучения (ARFI) для эластографии поперечными волнами (SWE). Измерение скорости сдвиговой волны в пределах ROI (длинная стрелка) гипоэхогенного очагового образования печени (короткая стрелка
Данное образование подтверждено как гемангиома при ультразвуковом исследовании с контрастом.
Vs = скорость поперечной волны. Глубина отображает расстояние от кожи до центра опухоли.
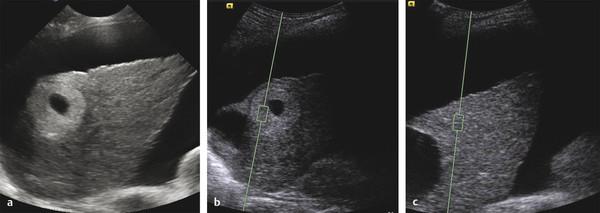
Рис. 4.2 Точечная эластография печени сдвиговой волной и очаговое образование печени. Пациент — 41-летний мужчина с циррозом печени, связанным с вирусом гепатита В, и известной почечно–клеточной карциномой почки. (a) Исходное ультразвуковое исследование показывает цирроз печени и асцит.
При необычном образовании обнаруживается яркий ободок и некротическое или кистозное новообразование. (b) представлено измерение ARFI от плоского края, Vs 1,09 м/с. (c) Измерение на аналогичной глубине в печени показало аномально высокий результат, соответствующий циррозу. Образование оказалось мягче, чем цирротическая печень. Подтвержденная биопсией гепатоцеллюлярная карцинома была выявлена.
Двумерная эластография сдвиговой волной
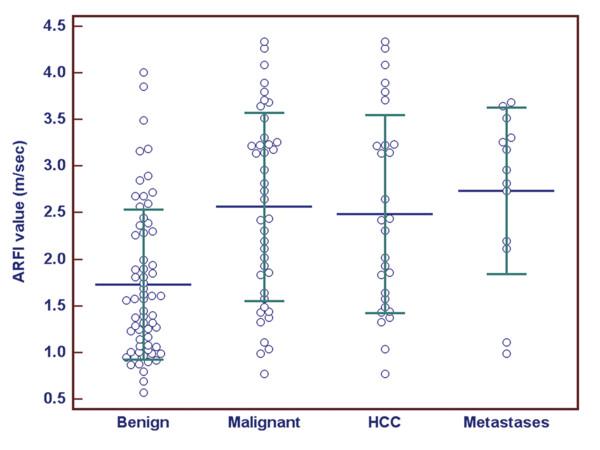
Двумерная эластография сдвиговыми волнами (Aixplorer, Supersonic Imagine, Экс-ан-Прованс, Франция) — это еще одна усовершенствованная эластографическая система, которая выполняет эластографию при прямой визуализации, также используя ARFI для генерации импульса, но показывая скорость сдвиговых волн при их распространении по ткани и создавая карту сдвиговых волн с цветовой кодировкой, на которой могут быть расположены интересующие области после замораживания изображения ( рис. 4.3). Разные цвета соответствуют разной жесткости ткани, подобно диапазону шкалы в цветовом допплерографическом исследовании, и это полезно для определения местоположения в цветовой рамке области интереса, размер которой также можно изменять. SWE также имеет шкалу, очень похожую на доплеровскую шкалу, которую можно регулировать в большую или меньшую сторону, чтобы помочь идентифицировать более жесткие участки в цветном поле. SWE измеряется в метрах в секунду или килопаскалях.
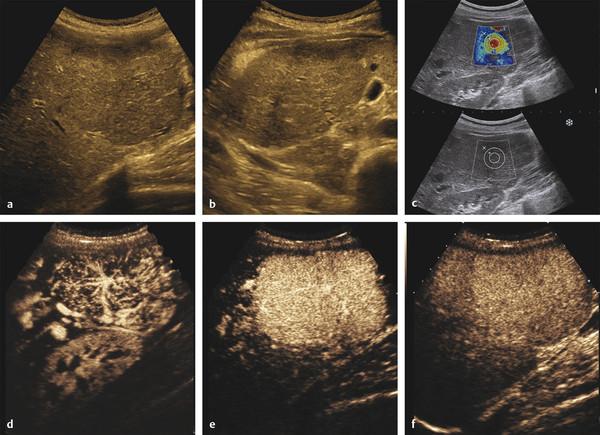
Рис. 4.3 Двумерная эластография сдвиговой волной в сочетании с ультразвуковым исследованием с контрастом при очаговом образовании печени. Пациентка — молодая женщина без симптомов, у которой случайно обнаружено выпуклое образование в правой доле, показанное на изображениях в продольном (a) и поперечном (b) сечениях. (c) представлена эластограмма центральной части опухоли, где наблюдается красный сигнал, сигнализирующий о жесткости ткани, вероятно, о наличии рубца. (d, e, f) демонстрируют изображения из CEU, что подтверждает классические признаки очаговой узловой гиперплазии. (d) — изображение MIP (проекция максимальной интенсивности) в артериальной фазе, где видно звездчатое Васкуляризация. (e) На пике артериальной фазы наблюдается равномерная гиперваскуляризация. (f) Отсроченное изображение через 5 минут показывает, что опухоль продолжает увеличиваться.
.2 Эластография деформации
Тензоэластография (SE) представляет собой метод, при котором на ткань осуществляется внешнее сжатие для сравнения ультразвуковых изображений до и после этого процесса. Области с минимальной деформацией показывают максимальную жесткость, тогда как мягкие ткани демонстрируют значительную деформацию.
Этот метод ограничен в применении, связанном с печенью, поскольку наружную компрессию трудно применить к органу, расположенному глубже реберного края. Креативные исследователи, однако, использовали изменения, возникающие при таких маневрах, как нормальное или усиленное дыхание, а также изменения, вторичные по отношению к сердечной пульсации, в качестве источников компрессии ( рис.
Эластография деформации также имеет недостатки, поскольку он не предлагает объективных измерений жесткости тканей и предоставляет лишь относительные данные о жесткости двух тканей в поле зрения (рис. 4.5).
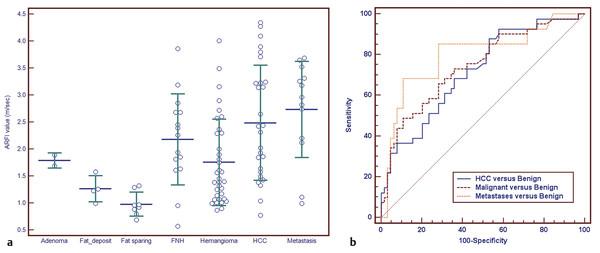
Рис. 4.4 Эластография деформации (SE) очагового образования печени. (a) Исходная аксиальная сонограмма в оттенках серого у молодой женщины с бессимптомным течением показывает два очаговых эхогенных образования внутри нормально выглядящей печени. (b) SE выполняется для наибольшей массы при наблюдении за печенью во время нормального спокойного дыхания. Большая масса выглядит синей (жесткой) по сравнению с более мягкой печенью (красной / зеленой). (c) Аналогично, меньшее по размеру эхогенное образование имеет синий цвет внутри окружающей его более мягкой красно-зеленой печени. При ультразвуковом исследовании с контрастированием доказано, что это гемангиомы.
Рис. 4.5 Тензоэластография очагового образования печени, представленного в черно-белом формате. Учитывая, что метод демонстрирует только жесткость массы по сравнению с печенью, черно-белое отображение является оптимальным, поскольку здесь не отображаются абсолютные показатели. Эта масса представляет собой мягкое жировое образование внутри более жесткой печени.
.3 Краткое описание
Очевидно, что только методы p-SWE и 2D-SWE позволяют непосредственно визуализировать очаговые образования печени, что обеспечивает их точное локализование для адекватной оценки жесткости. К дополнительным преимуществам обоих методов относится возможность выполнения стандартного полного ультразвукового исследования печени (УЗИ) одновременно с определением жесткости образования. В итоге, эластография может стать важной составляющей комплексного ультразвукового исследования печени, которое включает визуализацию в градациях серого и цветную допплерографию. Воспроизводимость результатов эластографии очаговых образований печени возможно, если образования четко видны при обычном УЗИ и находятся в благоприятном положении для исследования. Тем не менее, необходима также остановка дыхания, и хотя процедура занимает всего 3 секунды, некоторым пациентам это может быть затруднительно.
Внимание пациентам! Эластометрия печени. Важная новая информация
Эластометрия печени (ЭМ) методом сдвиговой волны за 10 лет после появления в ультразвуковых приборах ряда фирм доказала свою клиническую эффективность и рекомендуется для клинической неинвазивной оценки степени фиброза национальными и международными ассоциациями врачей гепатологов, инфекционистов, врачей ультразвуковой диагностики и др. специалистами.
Эластометрия печени (ЭМ) с использованием сдвиговых волн за последние 10 лет продемонстрировала свою клиническую значимость, и её применение рекомендуется для неинвазивной оценки степени фиброза различными национальными и международными ассоциациями специалистов, включая гепатологов и инфекционистов, а также специалистов по ультразвуковой диагностики.
Использование методов эластографии позволило отказаться от биопсии почти у 70% больных с хроническими гепатитами – циррозами. Получаемые цифры параметров жесткости и их обязательная трактовка соответствия разным степеням фиброза при всех хронических заболеваниях печени. Вместе с лабораторными данными, эти показатели необходимы для выбора курса лечения и его длительности, и наряду с анализами используются для оценки эффекта проводимой терапии (противовирусной и др.).
Показатели жесткости тканей, даже если они были измерены всего лишь один раз, имеют прогностическую ценность и важны для понимания состояния пациента. Например, для больных с циррозом более высокие значения жесткости связаны с большими шансами на развитие осложнений, таких как повреждения от варикозно расширенных вен пищевода или возникновение гепатоцеллюлярной карциномы.
Тем не менее, значения жесткости, полученные для конкретного пациента посредством эластометрии сдвиговой волны, не должны напрямую соотноситься с результатами, полученными другими методами, включая альтернативные режимы ультразвука, такие как транзиторная эластометрия на устройстве «Фиброскан» (FibroScan). Разные ультразвуковые технологии имеют свои диапазоны значений для различных стадий фиброза, и цифры, рекомендованные для Фиброскана, как правило, немного выше, чем те, что получены с помощью эластометрии сдвиговой волны.
Значения жесткости, получаемые при использовании эластометрии сдвиговой волны на приборах Phillips и такие же параметры, измеренные при эластометрии на приборах других производителей, применяющих аналогичный режим (Aixplorer, Siemens, General Electric и др.) по величинам также могут быть не вполне сопоставимы.
Несмотря на принципиальное сходство в методах, это различие обусловлено особенностями программного обеспечения и техническими характеристиками конкретных устройств. Каждая компания-изготовитель проводит обширные исследования с гистологическим подтверждением на своих аппаратах с использованием клинических центров по гепатологии.
По их результатам производители техники для своих аппаратов разрабатывают количественные значения диапазонов значений, соответствующих степеням фиброза и рекомендуемые пороговые величины. Еще раз повторим, что они между приборами разных фирм несколько отличаются (как, впрочем, отличаются цифры и на «Фиброскане», даже для разных его датчиков).
Задача врача, осуществляющего эластометрию, заключается в том, чтобы правильно зафиксировать данные и корректно их интерпретировать в соответствии с рекомендациями производителя, чтобы определить, к какой степени фиброза относится состояние пациента, от F0 до F4.
В июне 2017 года компания Phillips, в сотрудничестве с Российской Ассоциацией Специалистов Ультразвуковой Диагностики в Медицине, представила официальные методические рекомендации по выполнению эластографии с использованием сдвиговой волны на своих аппаратах (Epiq7, Epiq 5, Affinity 70), где указаны новые пороговые значения для стадий фиброза у пациентов с хроническим вирусным гепатитом С, от F>2 до F=4. В соответствии с рекомендациями Российской национальной ассоциации мы начали использовать эти обновлённые данные.
Но, как и прежде, в процессе интерпретации результатов эластографии у конкретного пациента, врач учитывает не только полученные средние величины жесткости, но и значения показателей информативности.
Таким образом, результат в 9,6 кПа (при установленном пороговом значении 9,54) не обязательно указывает на то, что пациент имеет фиброз F3. Статистически, это также предполагает, что небольшой процент пациентов с таким значением жесткости может иметь фиброз F2.
В то же время с результатом 8 кПа почти все пациенты будут иметь стадию фиброза F ≥ 2. А результат 15 кПа означает, что почти 100% пациентов с таким показателем будут иметь цирроз печени (пороговое значение 11.34), конечно при условии отсутствия сопутствующих факторов, повышающих жесткость печени
Важно учитывать, что пороговые значения жесткости, разработанные для хронического гепатита С, не могут быть непосредственным образом применены для других типов заболеваний печени. Однако сравнение результатов с известными средними нормами и динамикой у отдельного пациента считается достаточно корректным.
Кроме того, вдобавок к текущим рекомендациям РАСУДМ, были опубликованы данные других национальных ассоциаций, в которых уже указаны диапазоны значений эластометрии сдвиговой волны и для других заболеваний печени, таких как гепатиты В, неалкогольная жировая болезнь печени и некоторые другие состояния. Эти цифры варьируются в зависимости от нозологии. Например, пороговые значения жесткости для диагностики стадии F4, соответствующей циррозу, при алкогольном стеатогепатите значительно выше, чем для цирроза, вызванного хроническим гепатитом С.
Вне зависимости от наличия и выраженности фиброза паренхимы, жесткость печени увеличивается в случаях острого гепатита (или выраженного обострения хронического гепатита), в частности — при пятикратном и более повышении уровня трансаминаз.
Специалист по ультразвуковой диагностике, осуществляющий эластометрию печени, также оценивает другие ультразвуковые характеристики органа, включая показатели печеночного кровотока. Эти данные необходимы для комплексного анализа состояния печени и могут влиять на интерпретацию результатов эластометрии.
Ведь жесткость ткани печени в т.ч. также зависит от её кровенаполнения и может существенно повышаться при хронической сердечной недостаточности, тяжелой недостаточности трехстворчатого клапана и др. Определяемая жесткость ткани печени может существенно повышаться и при экстрапеченочном холестазе (блоке оттока желчи при желчекаменной болезни и др.). Словом, чтобы врач правильно интерпретировал полученные данные эластометрии, у него должна быть полная информация о нозологии процесса в печени.
Для того чтобы исследование было проведено на высоком уровне и результаты были корректными, очень важна основательная подготовка пациента. Например, метеоризм может повлиять на достоверность данных, а жесткость печени может изменяться после еды, если она была принята менее чем за три часа до тестирования, так как переваривание пищи увеличивает кровенаполнение печени.
Врач может заподозрить, что пациент не соблюдал рекомендации по подготовке, например, если на исследование пришел не натощак, что может быть видно по уменьшению размера желчного пузыря или увеличению кровотока в воротной вене печени.
Но уменьшенный желчный пузырь может быть и «запустевшим» при остром гепатите, а измененный кровоток по воротной вене по-разному меняется при разных ситуациях (и сам по себе важный показатель, который должен быть не искажен, и который врач также интегрально учитывает).
Таким образом, предоставляя неправильную или недостаточную медицинскую информацию, а также пренебрегая подготовительными мерами, пациент вводит в заблуждение не только врача ультразвуковой диагностики, но и прежде всего себя. В случае неправильной интерпретации результатов, какие бы они ни были зафиксированы, ответственность за это лежит на пациенте.
Хронические гепатиты и циррозы печени — хорошо известные факторы риска развития новообразований печени с высоким потенциалом их злокачественной трансформации. Выполняя комплексное УЗИ с эластометрией, помимо оценки жесткости паренхимы печени (что собственно и было основной задачей исследования), врач иногда первым может выявить очаговые образования печени и попытаться оценить их характер. Но, к сожалению, на фоне изменений ткани печени обычные УЗ критерии дифференциальной диагностики её очагов менее точны и обычно требуется дообследование дополнительными методами по стандартному алгоритму.
Если по результатам диагностики будет выявлено образование, которое выглядит «подозрительным», специалист обязательно порекомендует дальнейшее обследование с использованием более детальных методов, таких как УЗИ с контрастированием или МРТ печени. На основе этих дополнительных исследований помимо лечения гепатита и цирроза может быть рекомендовано наблюдение за образованием или его целевое лечение.
Эластометрию печени можно пройти в отделении лучевой диагностики нашего Лечебно-диагностического центра по адресу: ул. Ерошенко, 2Б.
Заведующий отделением лучевой диагностики,
врач УЗД высшей категории Туркин А.С.
Телефоны для записи на исследование:
Что значит средняя скорость в тканях печени 1 9м с на узи с эластографией
И.М. МИННЕМУЛЛИН 1, Д.Д. МУХАМЕТОВА 1, А.Р. КОРМИЛИНА 2, 3, М.Г. ТУХБАТУЛЛИН 2, 3, А.Х. ОДИНЦОВА 2, Н.А.
ЧЕРЕМИНА 2 , Л.Р. САДЫКОВА 2 , А.Ю. ХАСАНШИНА 2
¹Казанский государственный медицинский университет, г. Казань
2 Республиканская клиническая больница, г. Казань
3 Казанская государственная медицинская академия — филиал ФГБОУ ДПО РМАНПО, г. Казань
Контактная информация:
Миннемуллин Ильяс Мансурович — студент факультета «Лечебное дело»
Ультразвуковая эластография — это инструментальный метод диагностики, который позволяет быстро и без инвазивных вмешательств оценить эластичность тканей и получить косвенные данные о гистологических характеристиках. В данной статье описывается этот диагностический метод, его физические основы, методология проведения обследования, клиническая значимость для диагностики степени фиброза у пациентов с хроническими заболеваниями печени с позиции доказательной медицины, а также его преимущества и недостатки, факторы, которые могут исказить результаты, и перспективы использования в клинической практике.
Обсуждена возможность применения метода в качестве скрининга хронических заболеваний печени, его экономическая эффективность. Приведены результаты проведенных исследований на базе ГАУЗ «Республиканская клиническая больница» МЗ РТ. Были рассчитаны средние значения жесткости печени у пациентов с гепатитами различной этиологии, циррозом печени. Была оценена степень корреляция между средней жесткостью печени и индексами Child-Pugh, FIB4, лабораторными показателями (значениями гемоглобина, общего билирубина, общего белка, протромбина по Квику) и диаметром воротной вены.
I.M. MINNEMULLIN 1, D.D. MUKHAMETOVA 1, A.R. KORMILINA 2, 3, M.G. TUKHBATULLIN 2, 3, A.KH. ODINTSOVA 2, N.A.
CHEREMINA 2 , L.R. SADYKOVA 2 , A.YU. KHASANSHINA 2
¹Казанский государственный медицинский университет, Казань
2 Republic Clinical Hospital, Kazan
3 Казанская государственная медицинская академия — филиал ФГБОУ ДПО РМАНПО, Казань
Ultrasound elastography for estimating the fibrosis severity in chronic liver diseases
Контактные данные:
Minnemullin I.M. — student of the Faculty of General Medicine
Ультразвуковая эластография является методом инструментальной диагностики, который позволяет быстро и неинвазивным образом оценить эластичность и гистологические свойства тканей. В статье представлено описание данного метода: физические основы его функционирования, его методология, клиническая значимость в диагностике фиброза у пациентов с хроническими заболеваниями печени с точки зрения доказательной медицины, а также преимущества и недостатки, факторы, влияющие на достоверность результатов, и перспективы его применения в клинической практике. Обсуждается Возможность использования эластометрии в качестве скринингового метода и её экономическое значение.
In particular, the results of the studies conducted at Republic Clinical Hospital of the Republic of Tatarstan are presented. The average values of liver stiffness were calculated in patients with hepatitis of various etiologies and liver cirrhosis. The correlation was evaluated between the average liver stiffness and the Child-Pugh and FIB 4 indices, laboratory parameters (hemoglobin, total bilirubin, total protein, percentage of Quick’s prothrombin) and the portal vein diameter.
Ключевые слова: ультразвуковая эластография, диагностика хронических заболеваний печени, METAVIR.
Ультразвуковая эластометрия — это метод визуализации, который применяется в медицине для оценки эластичности и жесткости биологических тканей. Этот термин был введён врачами-исследователями из Хьюстона в 1991 году [1]. Синонимом является термин «фибросканирование», так как в клинической практике часто используются аппараты FibroScan.
Цирроз и другие хронические заболевания печени являются одними из основных причин заболеваемости и смертности во всем мире. Так, по данным метаанализа, проведенного группой авторов в 2020 г., цирроз печени стал причиной более 1,32 млн смертельных случаев (440 тыс. среди которых женщины, 883 тыс. — мужчины) во всем мире в 2017 г. [2].
Цирроз печени является заключительным этапом многих хронических диффузных заболеваний печени, таких как неалкогольная жировая болезнь печени, алкогольная болезнь печени, хронические инфекции гепатитом В и С. Хронические заболевания печени зачастую протекают бессимптомно благодаря высокой компенсаторной способности печени, и начинают проявляться клинически только на стадии декомпенсации и при появлении предвестников осложнений цирроза. Переход от бессимптомного компенсированного цирроза к декомпенсированному происходит со скоростью 5-7% в год [3]. При этом вероятность успешного лечения пациентов, вероятно, уменьшается по мере прогрессирования заболевания.
Ранняя диагностика может дать возможность более эффективно вмешиваться в течение заболевания, предотвращать прогрессирование заболевания до цирроза, его декомпенсации и/или гепатоцеллюлярной карциномы.
Недавние исследования продемонстрировали, что фиброз печени можно довольно точно диагностировать без инвазивных процедур, используя серологические тесты (например, тест ELF), транзиторную эластографию и различные рентгенографические техники [2]. Раннее обнаружение изменений в печени не только влияет на улучшение прогноза для пациента, но и может быть экономически целесообразным. Исследования показывают, что применение транзиторной эластографии в качестве метода скрининга для оценки фиброза печени у пациентов с неалкогольной жировой болезнью печени (НАЖБП) [4–7], алкоголем (АБП) [8] и гепатитом C [9] в первичной медицинской практике может быть экономически обоснованным. Для анализа экономической эффективности медицинского вмешательства применяется коэффициент инкрементной стоимости (ICER), который рассчитывается как разница в расходах между двумя вмешательствами, деленная на разницу в их результатах (отношение эффекта в группе, получившей вмешательство, к контрольной группе).
Физические основы метода
Эластичность — это свойство материала восстанавливать свой первоначальный объем и форму после воздействия деформирующей силы или стресса [10].
Эластичность представляет собой вид упругой деформации: под влиянием внешнего воздействия изменяются взаимные положения и расстояния между элементами материала, но после устранения воздействия эти изменения исчезают — то есть они обратимы. Когда сила увеличивается, деформация может стать пластичной, и изменения в материале сохраняются даже после прекращения нагрузки. Любые твердые материалы могут испытывать как упругие, так и пластические деформации, в зависимости от величины приложенных сил [11].
Важной характеристикой ткани является модуль упругости — отношение силы внешнего воздействия к деформации. Для определения эластичности обычно используются три модуля (их наглядное графическое представление на рис. 1):
- Модуль Юнга (продольная упругость) — это соотношение нормального напряжения к относительному удлинению, которое оно вызывает в направлении своего действия.
- Модуль сдвига (жесткость), G, — это способность материала противостоять сдвиговой деформации.
- Объемный модуль (объемная эластичность), K, — это признак того, насколько вещество устойчиво к сжатию.
Модуль упругости Влияет на скорость распространения волн (в том числе ультразвуковых) в материале. Колебания частиц в ультразвуковой волне могут быть параллельными или перпендикулярными направлению ее распространения. В газах и жидкостях распространяются только продольные волны, в изотропных твердых телах — как продольные, так и поперечные. Поперечные волны, также известные как сдвиговые, используют в методе «эластометрия сдвиговой волной».
Путем оценивания скоростей продольных (СL) и сдвиговых (СС) волн, а также плотности материалов можно вычислить модули упругости (кПа) или среднюю жесткость ткани (кПа).
Проведение эластометрии состоит из следующих этапов (схематично на рис. 2):
- Возбуждение тканей при помощи ультразвуковой волны, вибрационного датчика, руки врача либо соседнего пульсирующего сосуда, сердечных сокращений и дыхательной активности и т. д.
- (Квази) статическое или динамическое смещение ткани.
- Генерация сдвиговых волн.
- Выявление эффектов возбуждения (с использованием ультразвука, магнитного резонанса, датчиков давления и напряжения).
- Обработка полученных данных с помощью компьютера.
- Отображение информации в виде изображений или пространственных распределений деформаций и сдвиговых волн, а также модулей упругости или жесткости тканей (рис. 2). Обычно результаты представлены оператору вместе с обычным изображением ткани, показывающим места с различной жесткостью [10].
Методика проведения ультразвуковой эластометрии печени
Ультразвуковая эластометрия осуществляется утром натощак в положении лежа на спине, с поднятой правой рукой, чтобы облегчить доступ к правой доле печени. Датчик устанавливается в 9–11 межреберье на уровне, где проводится биопсия печени. Находится участок на глубине 2–3 см от капсулы печени, без крупных сосудистых структур, где проводится до 10 измерений (shots).
Результаты выражаются в кПа в диапазоне от 1,5 до 75 кПа, в то время как нормальные значения находятся около 5 кПа [12]. Возможно исследование конкретных сегментов печени, что требует аккуратного размещения датчика в их проекции. Подробнее об этом можно узнать из статьи Борсукова А.В. и Морозова Т.Г. [13]. Процедура обследования может варьироваться в зависимости от типа эластометрии.
Поддержка медицинских сообществ
Под эгидой Европейской федерации обществ ультразвука в медицине и биологии (European Federation of Societies for Ultrasound in Medicine and Biology — EFSUMB) публикуются руководства и рекомендации по использованию и интерпретации эластометрии. «Руководство и рекомендации EFSUMB по клиническому применению ультразвуковой эластографии» предназначены для того, чтобы служить справочником и практическим руководством для клинических пользователей. Наибольшее внимание уделено диффузным заболеваниям печени, далее следуют заболевания молочных желез, щитовидной железы, желудочно-кишечного тракта, эндоскопическая эластография, эластометрия предстательной железы и опорно-двигательного аппарата с использованием ультразвуковой эластографии деформации и сдвиговой волной в зависимости от обстоятельств [14, 15].
В ГАУЗ РКБ МЗ РТ активно проводятся клинические и диагностические исследования, а также научная работа с применением метода ультразвуковой эластометрии [16–18].
Методические рекомендации по хроническому гепатиту С, НАЖБП и АБП Российского общества по изучению печени для врачей, научного общества гастроэнтерологов России, Российского научного медицинского общества терапевтов также отмечают высокую значимость метода ультразвуковой эластографии для диагностика этих нозологий [19–21].
Клиническое значение эластометрии для диагностики степени фиброза печени при хронических заболеваниях органа
- Стеатоз печени. Этот метод основывается на упомянутом свойстве ультразвуковых сигналов «затухать» в жировых тканях. Путем расчета CAP (параметра контролируемого затухания в печени) удается выявить минимальную жировую дистрофию, начиная с 5% поражения печени, в отличие от УЗИ, где порог составляет 20%. Следует отметить, что на значение CAP не влияют фиброз и воспаление. Оценка стеатоза производится по следующим шкалам: S1 — 230–249,9 дб/м, S2 — 250–276,9 дб/м, S3 — 277 дб/м, однако эта шкала получает неоднородные интерпретации от разных авторов. Качество и точность эластометрии и ФиброТеста, согласно ROC-анализу, расцениваются как удовлетворительные: AUROC-0,7 и AUROC-0,8 соответственно.
- Алкогольная болезнь печени. Применение транзиторной эластографии при данной болезни имеет свои ограничения. Употребление алкоголя в больших количествах и развитие алкогольного гепатита влияют на показатели жесткости печени, определяемые при помощи эластографии, поэтому ее следует проводить после отказа от алкоголя, хотя срок такого воздержания пока не установлен. Чувствительность и специфичность диагностики тяжелого фиброза (F3) составляют 92% (89–96) и 70% (61–79), а для цирроза — 95% (87–98) [12].
Степень фиброза печени устанавливается через измерение скорости низкочастотной (50 Гц) механической волны. Чем жестче ткань, тем быстрее идет распространение поперечных волн.
Площадь под ROC-кривыми 0,84–0,89 для фиброза печени была достигнута этим методом с наилучшими показателями при умеренном и тяжелом фиброзе. Некоторые из новых ультразвуковых систем (Siemens и Supersonic Imagine) также могут оценивать скорость сдвиговой волны в различных местах печени, что делает возможным давать локальную оценку жесткости печени [23].
Для оценки фиброза используется сопоставление значений модуля упругости (кПа) с гистологической классификацией METAVIR, для которой референсные значения предоставляет производитель (например): до 5,8 кПа — отсутствует фиброз, стадия F0; от 5,9 до 7,2 кПа — стадия F1; от 7,3 до 9,5 кПа — стадия F2; от 9,6 до 12,5 кПа — стадия F3; более 12,5 кПа — стадия F4.
Ультразвуковая эластометрия показала свою высокую чувствительность и специфичность, значимую диагностическую ценность (табл. 1),что позволяет без проведения пункционной биопсии косвенно получать представление о гистологических свойствах ткани печени [23].
Таблица 1. Оценка степени фиброза печени по данным ультразвуковой эластометрии и гистологического исследования [23]
Table 1. Estimation of the expressed liver fibrosis by the data of ultrasound elastometry and histological examination [23]
Примечание: *ДИ — доверительный интервал.
Примечание: *ДИ — доверительный интервал.
Преимущества и недостатки метода
К достоинствам данного метода относятся: отсутствие инвазивности, высокая скорость и безболезненность, а также безопасность; исследование не требует сложной подготовки (за исключением отказа от алкоголя при алкоголизме); в отличие от биопсии, отвечает за визуализацию более обширного объема ткани (биоптат может быть взят из здорового участка, что повышает информативность); предоставляет точные результаты в реальном времени; не подвержен влиянию оператора.
Среди недостатков можно выделить: ограничения использования метода при асците, ожирении, узких межреберных промежутках; искажение результатов при наличии внепеченочного холестаза, застойной сердечной недостаточности, остром и хроническом гепатите, клеточной инфильтрации печени при лимфопролиферативных и онкологических заболеваниях, синдроме Бадда — Киари; недостаточная практика применения; отсутствие возможности сравнения результатов на различных аппаратах из-за различий в референсных значениях производителей [12, 24].
Исследование, проведенное на эластических фантомах (искусственные системы, позволяющие моделировать ткани с заданным значением жесткости), продемонстрировало зависимость результатов измерения от аппарата и глубины измерения [24–26].
Некоторые исследования показали высокую воспроизводимость результатов последующей межисследовательской оценки при условии «подготовленности» оператора [24].
Подробно о недостатках конкретных технологий эластометрии, их воспроизводимости, зависимости значений жесткости печени от различных факторов (вида датчика, положения пациента, глубины и области измерения, пола, массы тела, возраста пациента и других конкретных факторов) описано в работе Изранова В.А. и коллег [24].
Цель исследования заключается в оценке результатов эластометрии у пациентов с хроническими печеночными заболеваниями.
Материалы и методы
На базе ГАУЗ РКБ МЗ РТ проведено исследование 47 пациентов: 29 с циррозом печени (ЦП), 15 — с хроническим гепатитом (ХГ), 3 — с острым гепатитом. Средний возраст 44 [39; 56] лет, 19 мужчин (41%) и 28 женщин (59%).
Всем участникам была произведена эластометрия печени на аппаратах Aixplorer SuperSonic или MINDRAY Resona 7. Для определения степени фиброза использовались референсные значения: до 5,8 кПа — отсутствие фиброза, стадия F0 (по шкале METAVIR); от 5,9 до 7,2 кПа — стадия F1; от 7,3 до 9,5 кПа — стадия F2; от 9,6 до 12,5 кПа — стадия F3; более 12,5 кПа — стадия F4. Биохимический анализ крови был произведен с использованием автоматического анализатора Roche Cobas 6000, а клинический анализ — на Sysmex XN-100. В дальнейшем были изучены значения (медиана, среднее, минимальные и максимальные значения, 25 и 75 квартили) жесткости печени при циррозе, хроническом и остром гепатите, а также корреляция между жесткостью печени и лабораторными показателями (гемоглобином, общим билирубином, общим белком, протромбином по Квику, альбумин-глобулиновым коэффициентом), диаметром портальной вены, шкалой Чайлд — Пью и индексом FIB-4. Корреляционный и непараметрический анализ проводились с использованием надстройки «Анализ данных» в Microsoft Excel и в программе STATISTICA, версия 12.
Результаты
Выявленные изменения соответствуют литературным данным и подтверждают актуальность клинического применения данного метода для неинвазивной диагностики фиброза печени при различных хронических заболеваниях [23, 26, 27].
Таблица 2. Значения коэффициентов корреляции Пирсона и их качественная оценка
Table 2. Pearson correlation coefficients and their qualitative estimation
| Показатель | Средняя жесткость печени, кПа | Качественная оценка корреляции |
| индекс Чайлд — Пью | 0,80 | Высокая положительная корреляция |
| индекс FIB4 | 0,36 | Слабая положительная корреляция |
| Диаметр v.portae, мм | 0,59 | Средняя положительная корреляция |
| Тромбоциты, ммоль/л | -0,1717 | Очень слабая отрицательная корреляция |
| Общий билирубин, ммоль/л | 0,1704 | Очень слабая положительная корреляция |
| Гемоглобин, г/л | -0,1739 | Очень слабая положительная корреляция |
| Общий белок, г/л | -0,0033 | Очень слабая положительная корреляция |
| Процент протромбина по Квику | -0,48 | Средняя отрицательная корреляция |
| альбумин-глобулиновый коэффициент | -0,34 | Слабая отрицательная корреляция |
| Возраст, лет | 0,34 | Слабая положительная корреляция |
Заключение
По итогам литературного обзора, ультразвуковая эластометрия является эффективным инструментом для оценки тяжести фиброза печени, экономически обоснованным методом скрининга АБП, НАЖБП, хронического гепатита С. Специфичность, чувствительность и площадь под ROC-кривой метода оказались высокими. Результаты пилотного ретроспективного исследования показали высокую диагностическую точность ультразвуковой эластометрии печени для оценки выраженности фиброза у пациентов с циррозом печени, хроническим и острым гепатитами. Продемонстрирована высокая положительная корреляция между средней жесткостью печени (модулем упругости, кПа) и индексом Чайлд — Пью, средняя положительная корреляция с диаметром воротной вены и средняя отрицательная корреляция с процентом протромбина по Квику.
Рисунок 1. Модули упругости. Перевод с сохранением форматирования [3]
Figure 1. Modules of elasticity. Translated with preserved formatting [3]

Рисунок 2. Этапы проведения эластометрии. Перевод с сохранением форматирования [4]
Рисунок 2. Этапы эластометрии. Переведено с сохранением форматирования [4]

Рисунок 3. Значения показателей жесткости печени при циррозе печени, хроническом и остром гепатитах
Рисунок 3. Показатели жесткости печени при циррозе, хроническом и остром гепатите

Миннемуллин И.М.
Мухаметова Д.Д.
Тухбатуллин М.Г.
Одинцова А.Х.
Статья: Комбинированная эластография для диагностики фиброзов печени
Авторы: Norihisa Yada, Masatoshi Kudo. Департамент гастроэнтерологии и гепатологии, медицинский факультет Университета Киндай (ранее Кинки), Япония.
MEDIX-E008 (VOL63, 13-17, 2015)
Перевод статьи выполнен в ООО “Рус-эксп” (http://rus-exp.com) — официальный дистрибьютор FUJIFILM (HITACHI) в РФ.
Ультразвуковая эластография представляет собой ценную методику, позволяющую неинвазивно оценивать фиброз печени. Существует два разновидности эластографии: основанная на сдвиговых волнах и на анализе деформации тканей при сжатии (компрессионная эластография), включая количественную оценку данных. FUJIFILM (HITACHI) Aloka Medical, Ltd. (Япония) разработала технологию, которая позволяет выполнять оба типа эластографии с помощью одного конвексного датчика: измерение сдвиговых волн (SWM) и компрессионную эластографию (RTE).
Эластометрия сдвиговой волны SWM предлагает уникальный показатель VsN, позволяющий легко определить, какой из измеренных значений скорости сдвиговой волны Vs является верно измеренным, а какой – нет. В дополнение, компрессионная эластография RTE поддерживается на конвексном датчике для тучных пациентов.
Совмещение двух методов эластографии на одном устройстве упрощает понимание состояния печени при меньших затратах усилий.
1. ВВЕДЕНИЕ
Важно понять стадию фиброза и уровень воспаления печени. Это необходимо для планирования лечения и прогнозирования вирусных и других диффузных заболеваний печени. Биопсия печени является золотым стандартом, но это инвазивный метод (сопровождается болью и кровотечением) и очень области биопсии для исключения ошибки.
В последнее время ультразвуковая эластография становится признанным и эффективным подходом к неинвазивной оценке фиброза печени. Исследования также рассматривают возможность использования эластографии для оценки риска рака печени (1)(2). Другие источники указывают на то, что жесткость печени может значительно колебаться в зависимости от воспалительных процессов, желтухи и гиперемии (3)(4)(5)(6). Существует множество устройств, поддерживающих эластографию и связанные измерения, и выбор подходящей методики требует внимательного исследования их характеристик (таблица 1).
Таблица 1: Классификация ультразвуковой эластографии. Методики классифицируются по методу воздействия и физическим принципам. RTE: Real-Time Tissue Elastography (FUJIFILM (HITACHI)); VTI: Virtual Touch Imaging (Siemens); VTQ: Virtual Touch Quantification (Siemens); SWE: Shear Wave Elastography (FUJIFILM (HITACHI)). Приведено с некоторыми изменениями: Shiina JSUM Ultrasound Elastography Practice Guidelines. J Med Ultrasonics 2013 and Shiina T., Kudo M. et al: WFUMB Practice Guideline on Ultrasound Elastography. UMB2015
2. ЭЛАСТОГРАФИЯ СДВИГОВОЙ ВОЛНЫ (SHEAR WAVE IMAGING)
Сдвиговые волны имеют более высокую скорость распространения в твердых материалах, чем в мягких. Расчет модуля эластичности производится по формуле E = 3 ρ Vs², где Е обозначает модуль эластичности в кПа, ρ — плотность в кг/м³, а Vs — скорость сдвиговой волны (м/с), при условии, что ткани организма однородны.
Таким образом, жёсткость тканей может быть рассчитана с помощью измерения скорости распространения сдвиговых волн. Некоторые аппараты генерируют сдвиговые волны в тканях печени путем вибрирования датчиком, другие аппараты используют для этого сфокусированный ультразвуковой импульс.
Оценки жесткости печени (модуль упругости) E, скорости Vs или цветное картирование тканей отображаются на экране. Метод оценки жесткости печени, основанный на измерении скорости сдвиговой волны Vs, называется эластографией сдвиговой волны (Shear Wave Imaging). Уровень жесткости печени или соответствующие значения Vs увеличиваются по мере прогрессирования фиброза, что делает эти показания полезными для диагностики как фиброза, так и цирроза печени. В частности, это было продемонстрировано в случаях хронического гепатита С и В, где более высокая жесткость печени имеет связь с учащением случаев рака печени (1)(2).
3. ЭЛАСТОМЕТРИЯ СДВИГОВОЙ ВОЛНЫ (SWM)
На сегодня метод сдвиговых волн является наиболее изученным для диагностики фиброза печени. Этот режим доступен в аппаратах FUJIFILM (HITACHI) ALOKA, таких как Ascendus, Arietta V70, Arietta 850 и называется Shear Wave Measurement (SWM). Во время процедуры пациент лежит на спине и поднимает правую руку.
Левая доля печени визуализируется через правое межреберье, пока пациент задерживает дыхание. Сдвиговые волны генерируются с помощью сфокусированного ультразвукового импульса сразу после нажатия кнопки начала измерения. Результаты Vs отображаются на экране примерно через 2 секунды.
Интересующая область интереса (ROI) размером 1х1.5 см должна располагаться ниже капсулы печени и там, куда в область интереса не попадают крупные сосуды. Это помогает сгенерировать достаточное количество сдвиговых волн из равномерных импульсов. Метод SWM измеряет скорость Vs в точке и классифицируется как эластография сдвиговой волны в точке.
Если одно из измерений выходит за пределы нормального диапазона, это вызывает сомнения относительно его точности. Однако, если разброс измерений невелик, результат будет считаться корректным, несмотря на возможные неточности отдельных измерений. Уникальная особенность SWM заключается в отображении надежности результатов измерений.
SWM использует вычисление скорости в нескольких точках внутри области интереса в рамках одного измерения и отображает медианное значение Vs как результат. Распределение значений Vs представлено как интерквартильный размах (IQQ). Таким образом, дисперсию измеренных значений можно оценить с первого взгляда.
Также замеры с высокой дисперсией удаляются из медианного значения Vs. Пропорция надежных измерений Vs по отношению к общему количеству измерений представляется как VsN (Рисунок 1). Мы проводили измерения Vs у 186 пациентов с заболеваниями печени с помощью SWM (FUJIFILM (HITACHI)) и трех других аппаратов, сравнивая результаты.
Значения Vs, полученные на четырех аппаратах, показали высокую корреляцию (Рисунок 2). При наличии значительных различий (дисперсии) между значениями Vs четырех аппаратов, разность Vs (Δ Vs) была сопоставлена с VsN. Мы заметили резкое увеличение Δ Vs выше 0.75 м/с при значениях VsN ниже 60%.
Кроме того, когда расстояние между кожей (поверхностью тела) и капсулой печени превышало 2 см, значение VsN становилось ниже 60% (Рисунки 3 и 4). Поэтому мы считаем, что надежность измерений высока, если VsN больше или равно 60%. Если, напротив, VsN меньше 60%, то измеренные значения могут не соответствовать истинной жесткости печени.
Рисунок 1. Примеры эластометрии сдвиговой волны SWM. Если измерение адекватно, значение IQR будет низким. Большинство измерений будет надежным, и VsN примет высокое значение (а). Если измерение некорректно (например, из-за крупных сосудов в области интереса), IQR будет высоким, а VsN — низким (b).
Пример (a):  Пример (b):
Пример (b): 
Рисунок 2. Корреляция Vs между аппаратами различных производителей. SWM демонстрирует высокую согласованность с аппаратами других компаний, использующими методику сдвиговой волны. (a) SWM – аппарат компании А (b) SWM – аппарат компании B (c) SWM – аппарат компании С (d) Аппарат компании А – компании В (e) Аппарат компании А – компании С (f) Аппарат компании В – компании С.
Рисунок 3. Корреляция между VsN и Δ Vs. Если VsN опускается ниже 60%, разница между измерениями Vs на разных аппаратах (Δ Vs) увеличивается, что указывает на сложность получения точных измерений.
Рисунок 4. Зависимость между расстоянием от кожи до капсулы печени и VsN. Когда расстояние между поверзностью тела и капсулой печени больше 2 см, то VsN имеет тенденцию к падению ниже 60%.
4. КОМПРЕССИОННАЯ ЭЛАСТОГРАФИЯ
RTE (Real-Time Tissue Elastrography) – методика, которая отображает относительную деформацию тканей как цветовое картирование тканей в реальном времени, так называемая компрессионная эластография. Когда ткань подвергается внешней силе (деформации), то более твердые области ткани показывают относительно меньшее сжатие (strain), чем более мягкие области. Метод RTE измеряет смещения ткани в области интереса (ROI) и вычисляет деформацию путем пространственной дифференциации.
В ходе компрессионной эластографии более жесткие области отображаются синим, более мягкие — красным, а промежуточные зоны — зеленым. Цветовая палитра включает 256 градаций. При проведении компрессионной эластографии у пациентов с хроническими диффузными заболеваниями печени (например, гепатитом С) площади с низким сжатием (% синего цвета) увеличиваются со временем и принимают более сложную форму по мере прогрессирования фиброза печени.
Эти изменения в соотношении сжатия при хронических заболеваниях являются индикаторами прогрессирования фиброза печени (7) и наблюдаются через несколько независимых параметров изображения: среднее значение (MEAN) снижается по мере прогрессирования фиброза, в то время как стандартное отклонение (SD) растет. Площадь района низкого сжатия (синий цвет) также увеличивается со временем.
Уравнение для расчета индекса фиброза печени (LFI, LF Index) для объективной диагностики стадии фиброза печени было получено при помощи множественной регрессии (статистический анализ с использованием нейронных сетей — примечание переводчика) на базе этих и других значений полученного компрессионного изображения и сравнено с данным биопсии печени для хронического гепатита С (как обучающие референтные данные). Индекс фиброза печени LF Index автоматически рассчитывается в рамках режима измерений в ультразвуковом аппарате FUJIFILM (HITACHI) (8). LF Index постепенно растет с прогрессированием фиброза и значимо меняется между стадиями фиброза. AUROC для диагностики фиброза печени с использованием индекса LF Index F4, ≥F3 и ≥F2 занимает большое значение 0.800, 0.865 и 0.846 соответственно (9)(10)(11). Кроме того, изображение, полученное компрессионной эластографией RTE отображают уровень фиброза, при этом не обнаружено значимое влияние воспаления, желтухи или гиперемии на полученные данные.
Метод RTE изначально разрабатывался для исследования щитовидной и молочной желез, и для работы с линейными датчиками. Однако, данный датчик не всегда оптимален для оценки печени из-за высоких частот ультразвука.
На линейных датчиках также слабое проникновение ультразвукового луча, особенно для пациентов с большим количеством подкожного и висцерального жира или сложной печенью, причём эти области часто показываются синим цветом на эластограмме, что приводит к завышению фиброза. Для правильного диагноза необходимо выбрать область интереса (ROI), которая содержит мало подкожного жира, чтобы избежать недостаточного проникновения, множественных переотражений лучей. Также сосуды должны быть исключены из области интереса. Сложность, которая требует практики.
Конвексные датчики C251 / C252 (серия FUJIFILM (HITACHI) Arietta) и EUP-C715 (серия FUJIFILM (HITACHI) Hi Vision) с диапазоном частот от 1 до 5 МГц и глубиной проникновения 140 мм (и более) теперь доступны для использования в эластографии. Увеличение области сканирования как по глубине, так и по ширине улучшает диагностические возможности. С конвексным датчиком намного проще осуществлять обследование у пациентов с избыточной подкожной жировой клетчаткой, ожирением и стеатозом печени (так называемой «жировой печенью»), чем с линейным датчиком (с меньшими частотами 3-7 МГц) (Рисунок 5). Корреляция значений индекса фиброза печени LF Index между линейным и конвексным датчиками демонстрирует высокую степень сопоставимости, что свидетельствует о возможности получения стабильных результатов всеми операторами (врачи) ультразвукового аппарата (Рисунок 6).
Рисунок 5. Компрессионная эластография RTE с применением линейного и конвексного датчиков. У пациентов с значительным уровнем подкожного жира изображение RTE может проявляться в синем цвете, что затрудняет адекватную оценку (а). Используя конвексный датчик, с более широким углом обзора и лучшим проникновением, проводить RTE становится легче (b). Пример (а):  Пример (b):
Пример (b): 
Рисунок 6. Сравнение индекса фиброза печени на конвексном и линейном датчиках. Похожие значения LF Index индекса фиброза печени получены как на конвексном, так и на линейном датчиках.
5. КОМБИНИРОВАННЫЙ ПОДХОД К ЭЛАСТОГРАФИИ
Значения Vs, измеренные с помощью методики сдвиговой волны значительно различаются в зависимости не только от фиброза, но и воспаления, желтухи или гиперемии печени. С другой стороны, изменения относительной деформации при хронических заболеваниях печени, полученные в режиме компрессионной эластографии RTE отражают только прогрессирование фиброза печени с редким влиянием воспаления, желтухи или гиперемии печени на RTE-данные.
Таким образом, уровень воспалительных процессов, желтухи или гиперемии может оцениваться путем одновременного использования как сдвиговой волны, так и компрессионной эластографии с последующим анализом разниц между показателями, полученными по обеим методикам. Этот подход был описан на примере 27-летнего мужчины с острым гепатитом В. В В-режиме были зафиксированы легкое увеличение печени и небольшой объем асцита, а уровень аланинаминотрансферазы (АЛТ) составил 1290 IU.
Желтуха и гиперемия не наблюдались. LF Index составил 1.2 до начала лечения, что соответствует предполагаемой стадии фиброза печени F1. В то же время в режиме сдвиговых волн жесткость печени составила 8.8 кПа (на аппарате FibroScan, ECHOSENS), что соответствует стадии F3. Такое расхождение, вероятно, обусловлено воспалением, так как у пациента не было признаков желтухи или гиперемии.
Можно считать, что F1 находится в приблизительном диапазоне 3-4 кПа. Таким образом 3-4 кПа из 8.8 кПа до лечения объясняются влиянием фиброза, а оставшиеся 4-5 кПа отражают влияние воспаления. На самом деле, жёсткость печени постепенно снижалась с уменьшением АЛТ и восстановлением до 3.8 кПа через 6 недель. Расхождения между сдвиговой волной и компрессионной эластографией также исчезли (Рисунок 7).
Комбинированная эластография, которая включает в себя измерение скорости сдвиговых волн (Vs) и компрессионную эластографию RTE, является важным инструментом для адекватной диагностики заболеваний печени. Создание методов SWM и RTE на основе конвексного датчика позволяет проводить комбинированную эластографию с единственным датчиком. Использование ультразвуковой эластографии делает неинвазивную диагностику болезней печени более доступной.
Рисунок 7. Курс лечения и интерпретация клинического случая. Аланинаминотрансфераза (АЛТ) быстро улучшилась в результате лечения. Аналогично, печения также улучшилась. T-Bil (общий билирубин) и LF Index (индекс фиброза печени) остались на том же уровне во время лечения (а). Синяя область – отражение фиброза, а красная область – влияние воспаления (b).
ЛИТЕРАТУРА:
1) Masuzaki R и др. : Прогностическая оценка риска развития гепатоцеллюлярной карциномы у пациентов с хроническим гепатитом C с использованием временной эластографии. Hepatology2009; 49: 1954-1961.
2) Jung KS, et al. : Risk assessment of hepatitis B virusrelated hepatocellular carcinoma development using liver stiffness measurement (FibroScan). Hepatology 2011 ; 53 : 885-894.
3) Arena U и др. : Острый вирусный гепатит увеличивает значения жесткости печени, измеренные с помощью временной эластографии. Hepatology 2008; 47: 380-384.
4) Sagir A, et al. : Transient elastography is unreliable for detection of cirrhosis in patients with acute liver damage. Hepatology 2008 ; 47 : 592-595.
5) Millonig G и др. : Экстрагепатическая холестаза повышает жесткость печени (FibroScan) независимо от фиброза. Hepatology 2008; 48: 1718-1723.
6) Colli A и др. : Декомпенсированная хроническая сердечная недостаточность: увеличение жесткости печени, измеренной с помощью временной эластографии. Radiology 2010; 257: 872-878.
7) Shiina T, et al. : Mechanical model analysis for quantitative evaluation of liver fibrosis based on ultrasound tissue elasticity imaging. Japanese Journal of Applied Physics 2012 ; 51 : 07GF11 01-08.
8) Fujimoto K и др.: Неинвазивная оценка фиброза печени с использованием эластографии в реальном времени – оценка стадии по индексу фиброза печени (lf Index). Kanzo[in Japanese] 2010; 51: 539-541.
9) Yada N, et al. : Assessment of liver f brosis with realtime tissue elastography in chronic viral hepatitis. Oncology 2013 ; 84 Suppl 1 : 13-20.
10) Yada N и др. : Неинвазивная диагностика фиброза печени: полезность анализа данных как ультразвуковой эластографии, так и серологических находок для построения деревьев решений. Oncology 2014; 87 Suppl 1: 63-72.
11) Fujimoto K и др. : Новый метод анализа изображений с использованием ультразвуковой эластографии для неинвазивной оценки фиброза печени у пациентов. Oncology 2013; 84 Suppl 1: 3-12
Перевод и копирование материалов выполнен в компаниии ООО «Рус-эксп». Копирование текста без разрешения ООО «Рус-эксп» не допускается.
*Примечание: режим эластографии для оборудования FUJIFILM / HITACHI / ALOKA является опцией и требует установки дополнительного программного обеспечения и/или блоков.
**Примечание: производитель FUJIFILM (HITACHI) вправе изменить технические характеристики и возможности данной опции без уведомелния.
УЗИ аппараты: Спецпредложения
ul>
Специальное предложение на новейшие ультразвуковые аппараты экспертного класса: — ARIETTA 50 — ARIETTA 65. Производство аппаратов и датчиков — Япония, 2023 год. Бесплатная доставка и обучение.
Материал и методы
Исследование проводилось на базе МЛПУ «Клиническая больница N1» в гастроэнтерологическом отделении Смоленска с мая 2010 г. по май 2011 г. За указанный период обследованы 70 пациентов (36 мужчин и 34 женщины) в возрасте от 19 до 55 лет (p>0,05), страдающих АБП. Структура клинических форм АБП среди пациентов, принимавших участие в исследовании, была следующей: алкогольный стеатоз — 25 (35,7%) случаев, алкогольный гепатит — 23 (32,9%), алкогольный цирроз — 22 (31,4%). Из обследуемой группы были исключены пациенты, которые отказались от биопсии печени или имели противопоказания к ее проведению. Для установления стадии фиброза пациентам после получения информированного согласия выполняли пункционную биопсию печени по методу Менгини.
Стадии фиброза печени были оценены по системе METAVIR, и эти данные были сопоставлены с результатами эластографии, выраженными в кПа [3].
Биопсия печени 65 (92,8%) пациентам проводилась биопсийными пистолетами, иглами G 16-18, под ультразвуковым контролем. Всем больным осуществлялась комплексная ультразвуковая диагностика органов брюшной полости с допплерографией и оценкой портального кровотока на современном ультразвуковом приборе в дуплексном и триплексном режимах сканирования.
С целью более точной оценки как печени, так и селезенки у пациентов с алкогольной болезнью печени нами была предложена усовершенствованная методика комплексного эластографического обследования.
Эластографические исследования печени проводились в 7-10 зонах, при этом пациент располагал правую руку за голову. Датчик располагали в 6-м межреберье по правой передней подмышечной линии (проекция VII сегмента), в 5-м межреберье по правой среднеключичной линии (проекция VIII сегмента), а В 9-10 межреберьях по правой среднеключичной линии (проекция VI сегмента), по среднегрудинной линии в области эпигастрия (проекция II, III сегментов), в 8-ом и 7-ом межреберьях по правой среднеключичной линии (проекция V сегмента), и в 5-м межреберье по правой парастернальной линии (проекция IV сегмента).
Затем проводили эластографию селезенки из 7-10 зон в положении пациента на правом боку. Датчик устанавливали в 8-м межреберье по левой передней подмышечной линии (место проекции переднего полюса), в 11-м межреберье по левой задней подмышечной линии (место проекции заднего полюса), в 10-м межреберье по левой средней подмышечной линии (место проекции среднего сегмента), в 9-м межреберье по левой средней подмышечной линии (проекция между передним полюсом и средним сегментом), в 9-м межреберье между левой задней подмышечной и левой средней подмышечной линиями (проекция между задним полюсом и средним сегментом селезенки) (рис. 1, 2).

Рис. 1. Метод установки датчика во время эластографического исследования печени и селезенки.
1H — оптимальная область определения VII сегмента печени, 2H — оптимальная область определения VI сегмента печени, 3H — оптимальная область определения IV-VIII сегментов печени, 4H — оптимальная область определения V сегмента печени, 5H — оптимальная область определения II сегмента печени, 6H — оптимальная область определения III сегмента печени; 1L — оптимальная область определения заднего полюса селезенки, 2L — оптимальная область определения участка между передним и задним полюсом селезенки, 3L — оптимальная область определения переднего полюса селезенки.

Рис. 2. Метод установки эластографического датчика при проведении исследования селезенки в положении пациента на правом боку.
1L — оптимальная область для определения переднего полюса селезенки, 2L — оптимальная область для определения заднего полюса, 3L — оптимальная область для определения среднего сегмента, 4L — оптимальная область для определения проекции сегмента между передним полюсом и средним сегментом, 5L — оптимальная область для определения проекции сегмента между задним полюсом и средним сегментом селезенки.
Суммарный объем исследуемой ткани составляет в среднем 6 см 3 , что многократно превышает таковой при пункционной биопсии печени. Среднее значение характеризовало эластический модуль печени и селезенки. Результат выражали в кПа, допустимый интерквартильный коэффициент (IQR) — не более 1/4 показателя эластичности.
Для анализа данных эластографии, полученных при исследовании селезенки, мы разработали специальную шкалу, где количественные значения (кПа) представлены в виде «+» (табл. 1).
Таблица 1. Эластографические показатели печени в сопоставлении с METAVIR/Knodell (А.О. Буеверов, 2006, Ч.С. Павлов, 2010) и шкала эластографических показателей селезенки в сопоставлении с кПа (А.В. Борсуков,Т.Г.
Морозова, 2011).
| Стадия фиброза печени | Среднее значение по стадиям фиброза печени | Шкала эластографических показателей селезенки | Интервал средних значений для эластографии печени и селезенки |
|---|---|---|---|
| F0 | 5,2 | 0 | 3,9-6,5 |
| F1 | 6,4 | «+» | 4,8-8,0 |
| F2 | 8,5 | «++» | 6,3-10,7 |
| F3 | 10,8 | «+++» | 8,1-13,5 |
| F4 | 24,6 | «++++» | 18,5-30,7 |
Выражение количественных результатов (кПа) в виде «+» при исследовании селезенки необходимо ввиду потребности в дополнительных патологоанатомических исследованиях образцов гистологического материала паренхиматозного органа.
Результаты и обсуждение
При проведении импульсной эластографии печени по стандартной методике установлено: стадия F1 встречалась у 7 (10,7%) пациентов, F2 — у 6 (9,2%), F3 — у 7 (10,7%), F4 — у 17 (26,2%) обследуемых. При использовании усовершенствованной методики эластографии печени было установлено, что F1 — фиброзные изменения имеют 12 (18,5%) человек, F2 — 10 (15,4%), F3 — 11 (16,9%), F4 — 22 (33,8%) пациента (p>0,05). Проведен анализ исследований, в которых сравнивается диагностическая точность ультразвуковой эластографии печени, селезенки и биопсии печени (табл. 2).
Таблица 2. Сравнительный анализ результатов эластографии печени и селезенки, а также гистологического исследования печени у 65 пациентов с алкогольной болезнью печени.
| Гистологические данные | Показатели непрямой эластографии печени и селезенки | ||||||
|---|---|---|---|---|---|---|---|
| Стадия фиброза печени | Число больных (абс., %) | Число больных с данной стадией фиброза по эластографии печени (абс., %) | Среднее значение, кПа | Шкала эластографического исследования селезенки | Число больных с данной стадией фиброза по эластографии селезенки (абс., %) | Среднее значение, кПа | Интервал средних значений, кПа |
| F0 | 10 (15,4) | 8 (12,4) | 5,3±0,2 | 0 | 8 (12,4) | 4,4±0,2 | 3,9-6,5 |
| F1 | 12 (18,5) | 13 | (20) 7,4±0,1 | «+» | 10 (15,4) | 6,7±0,2 | 4,8-8,0 |
| F2 | 10 (15,4) | 11 (16,9) | 8,8±0,1 | «++» | 9 (13,6) | 8,4±0,2 | 6,3-10,7 |
| F3 | 11 (16,9) | 11 (16,9) | 11,7±0,3 | «+++» | 8 (12,4) | 12,3±0,6 | 8,1-13,5 |
| F4 | 22 (33,8) | 22 (33,8) | 40,8±4,3 | «++++» | 22 (33,8) | 37,7±4,5 | 18,5-30,7 |
| «++++»* | 8 (12,4) | 20,5±2,1 | 18,5-30,7 | ||||
Примечание. * — у 8 пациентов со стадией F1-F2-F3 по показателям эластографии печени показатель эластографии селезенки составил F4.
Соответствие результатов непрямой одномоментной эластометрии печени и морфологического исследования ее биоптатов было отмечено у 63 (96,9%) обследуемых.
Что значит средняя скорость в тканях печени 1 9м с на узи с эластографией
С развитием новых инструментальных технологий неинвазивная диагностика плотности печеночной ткани становится всё более актуальной, предлагая доступный и сравнительно простой способ проведения исследований. Ультразвуковая эластография, оставляя все преимущества стандартных ультразвуковых методов диагностики, существенно повышает точность измерения плотности тканей печени.
Если ранее фибросканирование выполнялось на аппарате, предназначенном только для этого исследования, то в настоящее время протоколом выполнения эластографии производители активно снабжают многие ультразвуковые аппараты экспертного класса. Это, в свою очередь, позволяет проводить исследование практически повсеместно, расширить область применения, не ограничиваясь лишь гастроэнтерологией. С учетом имеющегося вариативного ряда типов эластографии остро встает вопрос особенностей каждого типа, области применения и имеющихся ограничений самой методики. Практический опыт самого врача играет не менее важную роль, а иногда не только сопоставимую с классом самого ультразвукового аппарата, но даже превышающую его значимость. В связи с этим важен обмен опытом между клиницистами по применению эластографии печени и других органов при различной патологии данных органов, сопровождающейся изменением плотности их паренхимы.
600 KBэластографияпеченьфибросканированиеультразвуковая диагностикафиброз печеницирроз печени
1. Готье С.В., Мойсюк Я.Г., Хомяков С.М. Донорство и трансплантация органов в Российской Федерации в 2013 году. VI сообщение регистра Российского трансплантологического общества // Вестник трансплантологии и искусственных органов. 2014. Т. XVI. № 2. С. 5-23.
2. Новрузбеков М.С., Гуляев В.А., Луцык К.Н. Ахметшин Р.Б., Олисов О.Д., Магомедов К.М., Казымов Б.И., Яремин Б.И., Хубутия М.Ш. Программа трансплантации печени в НИИ скорой помощи имени Н.В. Склифосовского – этапы, достижения, перспективы // Вестник медицинского института «РЕАВИЗ». Реабилитация, Врач и Здоровье.
2020. № 3. С. 162-173.
3. Ивашкин В.Т., Драпкина О.М., Маев И.В., Маев И.В., Трухманов А.С., Блинов Д.В., Пальгова Л.К., Цуканов В.В., Ушакова Т.И. Распространенность неалкогольной жировой болезни печени у пациентов амбулаторно-поликлинической практики в Российской Федерации: результаты исследования DIREG 2 // Российский журнал Гастроэнтерологии, Гепатологии, Колопроктологии. 2015. № 6. С. 31-41.
4. Макаров И.О., Боровкова Е.И., Казаков Р.Д. Распространенность неалкогольной жировой болезни печени у беременных с ожирением // Акушерство, гинекология и репродукция. 2012. Т. 6. № 4. С. 18-21.
5. Pacana T., Fuchs M. The cardiovascular link to nonalcoholic fatty liver disease // Clin Liver Dis. 2012. № 16. P. 599-613.
6. Блинов Д.В., Зимовина У.В., Ушакова Т.И. Оценка фармакоэпидемиологии гепатотропной терапии в реальных условиях клинической практики // Фармакоэкономика. Современная фармакоэкономика и фармакоэпидемиология. 2015. № 1. С. 31-38.
7. Ovchinsky N., Moreira R.K., Lefkowitch J.H., Lavine J.E. Роль биопсии печени в современной клинической практике: взгляд педиатров // Adv Anat Pathol. 2012. Vol. 19 (4).
P. 250-262.
8. Takyar V., Etzion O., Heller T., Kleiner D.E., Rotman Y., Ghany M.G., Fryzek N., Williams V.H., Rivera E., Auh S., Liang T.J., Hoofnagle J.H., Koh C. Осложнения перкутанных биопсий печени с использованием игл Клатскина: 36-летний опыт одного центра // Aliment Pharmacol Ther. 2017. Vol. 45 (5). P. 744-753.
9. Towbin A.J., Serai S.D., Podberesky D.J. Magnetic resonance imaging of the pediatric liver: imaging of steatosis, iron deposition and fibrosis // Magn Reson Imaging Clin N Am. 2013. Vol. 21 (4).
P. 669-680.
11. Kim D.W., Suh C.H., Kim K.W., Pyo J., Park C., Jung S.C. Technical Performance of Two-Dimensional Shear Wave Elastography for Measuring Liver Stiffness: A Systematic Review and Meta-Analysis // Korean J. Radiol. 2019. Vol. 20 (6).
10. Заривчацкий М.Ф., Каменских Е.Д., Мугатаров И.Н. Опыт применения пункционной биопсии при сфокусированных заболеваниях печени // Экспериментальная и клиническая гастроэнтерология. 2018. Вып. 156. № 8. С. 55-58.
12. Fang C., Konstantatou E., Romanos O., Yusuf G., Quinlan D., Sidhu P. Reproducibility of 2-Dimensional Shear Wave Elastography Assessment of the Liver: A Direct Comparison With Point Shear Wave Elastography in Healthy Volunteers // J. Ultrasound Med. 2017. Vol. 36. P. 1563-1569.
P. 880-893.
15. Elsayed E.Y., Mohamed I.E., Ezzat I.M. The sensitivity of different non-invasive methods in diagnosis of liver fibrosis in chronic hepatitis C virus patients // New York Science Journal. 2016. Vol. 9 (7).
13. Ferraioli G., Tinelli C., Lissandrin R., Zicchetti M., Bello B., Filice G., Filice C. Метод точечной сдвиговой эластографии для оценки жесткости печени // World J. Gastroenterol. 2014. Vol. 20. P. 4787-4796.
14. Bedossa P., Dargère D., Paradis V. Варьируемость образцов фиброза печени при хроническом гепатите C // Hepatology. 2003. Vol. 38. P. 1449-1457.
16. Dietrich C.F., Bamber J., Berzigotti A. EFSUMB Guidelines and Recommendations on the Clinical Use of Liver Ultrasound Elastography // Ultraschall Med. 2017. Vol. 38 (4). P. e16-e47.
P. 68-75.
18. Ferraioli G., Filice C., Castera L., Choi B.I., Sporea I., Wilson S.R., Cosgrove D., Dietrich C., Amy D., Bamber J., Barr R., Chou Y., Ding H., Farrokh A., Friedrich-Rust M., Hall T., Nakashima K., Nightingale K., Palmeri M., Schafer F., Shiina T., Suzuki S., Kudo M. WFUMB guidelines and recommendations for clinical use of ultrasound elastography // Ultrasound Med Biol. 2015. Vol. 41 (5). P. 1161-1179.
17. Cosgrove D., Piscaglia F., Bamber J., Bojunga J., Correas J.M., Gilja O.H., Klauser A.S., Sporea I., Calliada F., Cantisani V., D’Onofrio M., Drakonaki E.E., Fink M., Friedrich-Rust M., Fromageau J., Havre R.F., Jenssen C., Ohlinger R., Săftoiu A., Schaefer F., Dietrich C. Рекомендации EFSUMB по клиническому применению ультразвуковой эластографии. Часть 2: Клинические приложения // Ultraschall Med. 2013. Vol. 34 (3).
P. 238-253.
20. Barr R., Ferraioli G., Palmeri M., Goodman Z., Garcia-Tsao G., Rubin J., Garra B, Myers R., Wilson S., Rubens D., Levine D. Elastography Assessment of Liver Fibrosis: Society of Radiologists in Ultrasound Consensus Conference Statement // Radiology. 2015. Vol. 276 (3). P. 845-861.
19. Ferraioli G., Wong V., Castera L., Berzigotti A., Sporea I., Dietrich C., Choi B., Wilson S., Kudo M., Barr R. Обновление рекомендаций Всемирной федерации ультразвука в медицине и биологии по ультразвуковой эластографии печени // Ultrasound in Medicine & Biology. 2018. Vol. 44 (12). P. 2419-2440.
23. Gersak M., Sorantin E., Windhaber J., Dudea S., Riccabona M. The influence of acute physical effort on liver stiffness estimation using Virtual Touch Quantification (VTQ). Preliminary results // Medical Ultrasonography. 2016. Vol. 18 (2).
21. Sigrist R., Liau J., Kaffas A., Chammas M., Willmann J. Ультразвуковая эластография: обзор методов и клинических приложений // Theranostics. 2017. Vol. 7 (5). P.1303-1329.
22. Jeong J., Kim T., Sohn J., Kim Y., Jeong W., Oh Y., Yoo K. Реализация эластографии сдвиговых волн в хронических заболеваниях печени: точность в прогнозировании фиброза печени на основе сывороточных маркеров // World J. Gastroenterol. 2014. Vol. 20 (38). P. 13920-13929.
24. Fang C., Lim A., Sidhu P. Ultrasound-based liver elastography in the assessment of fibrosis // Clin Radiol. 2020. Vol. 75 (11). P. 822-831.
25. Dietrich C.F., Bamber J., Berzigotti A., Bota S., Cantisani V., Castera L., Cosgrove D., Ferraioli G., Friedrich-Rust M., Gilja O.H., Goertz R.S., Karlas T., Knegt R., Ledinghen V., Piscaglia F., Procopet B., Saftoiu A., Sidhu P.S., Sporea I., Thiele M. Рекомендации и руководства EFSUMB по клиническому использованию ультразвуковой эластографии печени // Европейский журнал ультразвука. 2017. Т. 38 (4). С. 16-48.
26. Dong Y., Sirli R., Ferraioli G., Sporea I., Chiorean L., Cui X., Fan M., Wang W., Gilja O., Sidhu P., Dietrich C. Обзор нормальных значений сдвиговой волновой эластографии печени // Z Gastroenterol. 2017. Т. 55. С. 153-166.
27. Das K., Sarkar R., Ahmed S., Mridha A., Mukherjee P., Das K., Dhali G., Santra A., Chowdhury A. «Normal» liver stiffness measure (LSM) values are higher in both lean and obese individuals: a population-based study from a developing country // Hepatology. 2012. Vol. 55 (2). P. 584-593.
28. Fung J., Lee C., Chan M., Seto W., Wong D., Lai C., Yuen M. Определение нормального диапазона жесткости печени у здоровых китайцев без заболеваний печени // PLoS One. 2013. Т. 8 (12). С. e85067.
29. Barr R., Ferraioli G., Palmeri M., Goodman Z., Garcia-Tsao G., Rubin J., Garra B., Myers R., Wilson S., Rubens D., Levine D. Elastography Assessment of Liver Fibrosis: Society of Radiologists in Ultrasound Consensus Conference Statement // Radiology. 2015. Vol. 276. no. 3. P. 845-861.
30. Xu X., Su Y., Song R., Sheng Y., Ai W., Wu X., Liu H. Эффективность транзиентной эластографии в оценке фиброза при монозаражении вирусом гепатита B: систематический обзор и мета-анализ диагностического теста // Hepatol Int. 2015. Т. 9 (4). С. 558-566.
31. Li Y., Huang Y., Wang Z., Yang Z., Sun F., Zhan S., Liu X., Zhuang H. Систематический обзор с мета-анализом: диагностическая точность транзиентной эластографии для стадирования фиброза печени у пациентов с хроническим гепатитом B // Aliment Pharmacol Ther. 2016. Т. 43. С. 458-469.
32. Xiangdong Hu, Lanyan Qiu, Dong Liu, Linxue Qian. Acoustic Radiation Force Impulse (ARFI) Elastography for non-invasive evaluation of hepatic fibrosis in chronic hepatitis B and C patients: a systematic review and meta-analysis // Med Ultrason. 2017. Vol. 19 (1).
С. 23-31.
33. Fu J., Wu B., Wu H., Lin F., Deng W. Accuracy of real-time shear wave elastography in staging hepatic fibrosis: a meta-analysis // BMC Med Imaging. 2020. Vol. 20 (1). P. 16.
34. Jiang W., Huang S., Teng H., Wang P., Wu M., Zhou ., Ran H. Диагностическая точность эластографии с применением точечного сдвига и транзиентной эластографии для стадирования печеночного фиброза у пациентов с неалкогольной жировой болезнью печени: мета-анализ // BMJ Open. 2018. Т. 8 (8). С. e021787.
35. Herrmann E., de Lédinghen V., Cassinotto C., Chu W.C., Leung V.Y., Ferraioli G., Filice C., Castera L., Vilgrain V., Ronot M., Dumortier J., Guibal A., Pol S., Trebicka J., Jansen C., Strassburg C., Zheng R., Zheng J., Francque S., Vanwolleghem T., Vonghia L., Manesis E., Zoumpoulis P., Sporea I., Thiele M., Krag A., Cohen-Bacrie C., Criton A., Gay J., Deffieux T., Friedrich-Rust M. Оценка фиброза печени, подтвержденного биопсией, с помощью двумерной эластографии сдвиговой волны: мета-анализ на основе индивидуальных данных пациентов // Гепатология. 2018. Т. 67 (1). С. 260-272.
36. Ferraioli G., De Silvestri A., Lissandrin R., Maiocchi L., Tinelli C., Filice C., Barr R. Evaluation of Inter-System Variability in Liver Stiffness Measurements // Ultraschall Med. 2019. Vol. 40. P. 64-75.
37. Shin H., Kim M., Kim H., Roh Y., Lee M. Сравнение скорости сдвиговых волн при ультразвуковой эластографии между различными приборами, датчиками и глубиной получения данных: экспериментальное исследование // Eur Radiol. 2016. Т. 26 (10). С. 3361-3367.
38. Snowdon V., Guha N., Fallowfield J. Noninvasive evaluation of portal hypertension: emerging tools and techniques // Int. J. Hepatol. 2012. DOI: 10.1155/2012/69108 9.
39. Shi K., Fan Y., Pan Z., Lin X., Liu W., Chen Y., Zheng M. Транзиентная эластография: мета-анализ диагностической точности в оценке портальной гипертензии при хронических заболеваниях печени // Liver Int. 2013. Т. 33 (1). С. 62-71.
40. Thiele M., Hugger M., Kim Y., Rautou P., Elkrief L., Jansen C., Verlinden W., Allegretti G., Israelsen M., Stefanescu H., Piscaglia F., García-Pagán J., Franque S., Berzigotti A., Castera L., Jeong W., Trebicka J., Krag A. Применение двумерной сдвиговой волновой эластографии печени с помощью Aixplorer для выявления портальной гипертензии при циррозе: мета-анализ на основе индивидуальных данных пациентов // Liver Int. 2020. Т. 40 (6). С. 1435-1446.
41. EASL-ALEH Clinical Practice Guidelines: Non-invasive tests for evaluation of liver disease severity and prognosis // J. Hepatol. 2015. Vol. 63. P. 237-264.
42. Knop V., Hoppe D., Welzel T., Vermehren J., Herrmann E., Vermehren A., Friedrich-Rust M., Sarrazin C., Zeuzem S., Welker M. Обратное развитие фиброза и портальной гипертензии при циррозе, ассоциированном с HCV, и стойкий вирусологический ответ после противовирусной терапии без интерферона // J. Viral Hepat. 2016. Т. 23 (12). С. 994-1002.
43. Ding Y., An Z., Wang S., Dou X. Efficacy evaluation of entecavir anti-fibrosis treatment in chronic hepatitis B with real-time shear wave elastography and ultrasound quantitative score // J. Chin Clin Med Imaging. 2016. Vol. 27 (6). P. 407-410.
44. Tada T., Kumada T., Toyoda H., Ito T., Sone Y., Okuda S., Tsuji N., Imayoshi Y., Yasuda E. Использование реальной сдвиговой волновой эластографии для оценки фиброза печени у пациентов с хроническим гепатитом C без цирроза // Hepatol Res. 2015. Т. 45 (10). С. 122-129.
45. Boursier J., Vergniol J., Guillet A., Hiriart J., Lannes A., Le Bail B., Michalak S., Chermak F., Bertrais S., Foucher J., Oberti F., Charbonnier M., Fouchard-Hubert I., Rousselet M.C., Cales P., Ledinghen V. Диагностическая точность и прогностическое значение анализа крови на фиброз и измерения жесткости печени с помощью FibroScan при неалкогольной жировой болезни печени // Журнал гепатологии. 2016. Т. 65. С. 570-578.
46. Bonder A., Tapper E.B., Afdhal N.H. Contemporary assessment of hepatic fibrosis // Clin Liver Dis. 2015. № 19 (1). Р. 123-134.
47. Ferraioli G., Tinelli C., Dal Bello B., Zicchetti M., Filice G., Filice C. Точность реальной сдвиговой волновой эластографии при оценке фиброза печени при хроническом гепатите C: пилотное исследование // Гепатология. 2012. Т. 56, № 6. С. 2125-2133.
Ежегодно в мире выполняются более 8000 трансплантаций печени. Лекарственно индуцированное поражение печени заняло лидирующее место среди всех интоксикационных причин поражения печени [1, 2]. По данным ВОЗ, примерноодна треть всех жителей Земли заражена тем или иным вирусом гепатита, что ежегодно приводит к смерти около 1 млн человек.
В последние годы в России среди пациентов с острым гепатитом C наблюдается преобладание молодых людей в возрасте от 15 до 29 лет (70–80%), тогда как доля детей составляет 3,3–3,6%. Широко распространен метаболический синдром, и неалкогольная жировая болезнь печени (НАЖБП), являющаяся одним из его аспектов, может стать одной из основных причин цирроза и рака печени [3]. Общая распространенность НАЖБП варьирует от 20 до 40%. Однако среди пациентов с ожирением или сахарным диабетом 2 типа этот показатель значительно возрастает — до 70–90% [4,5]. Таким образом, метаболический синдром, а также ожирение и сахарный диабет 2 типа могут рассматриваться как важные факторы риска для развития НАЖБП [6].
Цель данного литературного обзора — выявить влияние ультразвуковой эластографии сдвиговой волной на диагностику диффузных заболеваний печени.
В настоящее время биопсия печени остается золотым стандартом диагностики паренхиматозных изменений печени [7], потому что она наиболее точно позволяет оценить степень фиброза [8, 9]. Но необходимо помнить, что это инвазивная процедура, которая может привести к ряду осложнений. К основным осложнениям, развивающимся после биопсии печени, следует отнести кровотечение в брюшную полость, декомпенсацию основного заболевания, подкапсульную гематому, болевой синдром после биопсии, вторичную инфекцию после манипуляции, повреждение рядом расположенных органов [10].
Биопсия печени и эластография. Эластография печени представляет собой неинвазивный метод диагностики, который в отличие от биопсии обеспечивает высокую комплаентность у пациентов и хорошую воспроизводимость [11, 12, 13]. Биопсия может сопровождаться ошибками при отборе образцов и риском осложнений, а также имеет высокую вариабельность результатов гистологического анализа [14].
Сама «эластография», как и «фибросканирование», разрабатывалась на основе получаемых ультразвуковых данных от тех же пациентов, которым для верификации степени фиброза выполнялась пункционная биопсия [15, 16]. Сопоставление эластографических показателей с классификацией фиброза по морфологической шкале METAVIR представлено в таблице 1.
Сравнение данных эластографии с классификацией фиброза, основанной на морфологической шкале METAVIR
значение жесткости печени, кПа
Звездчатое расширение портальных трактов без образования септ
Увеличение портальных трактов с одиночными септами (более одного септа)
Эластографию можно разделить на несколько видов в зависимости от особенностей аппарата и способа определения жесткости органа: компрессионная эластография; транзиентная эластография (Fibroscan); эластография сдвиговых волн (точечная – ElastPQ); эластография сдвиговых волн (двумерная – ElastQ); магнитно-резонансная эластография.
Рекомендации по проведению эластографии печени можно найти в материалах Европейской федерации ультразвука в медицине и биологии (EFSUMB) [17], Всемирной федерации ультразвука в медицине и биологии (WFUMB) [18, 19] и Консенсусе Общества радиологов по ультразвуку [20].
Эластография сдвиговой волной осуществляется путем генерации акустического импульса, который передается датчиком на область интереса, где регистрируется скорость распространения поперечной волны. Модуль упругости ткани вычисляется по формуле: E= 3pc², где E — эластичность ткани, C — скорость сдвиговой волны и ρ — плотность ткани в кг/м³. Таким образом, скорость сдвиговой волны служит количественным показателем абсолютной эластичности ткани. Существует несколько различных методов измерения скоростей сдвиговой волны, среди которых транзиентная эластография (TE) (Fibroscan), точечная эластография сдвиговой волной (ElastPQ) и двумерная эластография сдвиговой волной (ElastQ) [21]. Из этих методов эластография сдвиговой волной является относительно новой техникой, позволяющей количественно оценить жесткость тканей.
Для получения достоверных результатов, чтобы избежать ложно повышенных показателей жесткости печени, пациентам необходимо голодать минимум 2 часа и отдыхать 10 минут перед обследованием [22].Исследования проводятся в положении пациентов лежа на спине, с вытянутой правой рукой над головой, чтобы увеличить межреберье. Измерения жесткости правой доли печени проводятся из межреберного доступа.При использовании метода транзиентной эластографии не выделяется область, представляющая интерес, поскольку отсутствует визуализация печени, а показания получаются из воспринимаемой правильной области печени.При ультразвуковых методах, при которых визуализируется печень, операторы должны поместить область интереса в правую долю печени, избегая любых теней ребер, крупных кровеносных сосудов и желчных протоков [23]. Кроме того, как для ElastPQ, так и для ElastQ датчик должен быть перпендикулярен капсуле печени. Использование медианы из 10 измерений в качестве значения жесткости было рекомендовано в качестве стандартной практики при использовании метода транзиентной эластографии и впоследствии было принято в качестве требуемого количества измерений в клинической практике большинством исследований точечной эластографии сдвиговой волной и стало принятым необходимым количеством измерений, подтвержденным в указанных ранее рекомендациях EFSUMB и WFUMB [19, 24].В то же время есть данные, свидетельствующие о том, что меньшее количество измерений может быть приемлемым при использовании ElastPQ [25]. Литература по измерению жесткости печени у здоровых добровольцев обобщена Dong et al. [26].Среди более крупных исследований среднее/медианное значение жесткости печени с использованием метода транзиентной эластографии колеблется от 4,1 до 5,5 кПа с рассчитанным максимальным верхним 95%-ным центилем 8,7 кПа [27, 28].Также обществом радиологов в ультразвуке в консенсусе, утвержденном на итоговой конференции в 2016 году, предложены точные значения показателей жесткости в kPa, соответствующие стадиям классификации фиброза по Metavir для каждого типа эластографии с учетом производителя аппарата, данные представлены в таблице 2 [29].
Сравнение показателей эластографии в зависимости от метода обследования (Консенсус конференция по ультразвуковой эластографии для фиброза печени)
Без выраженного фиброза No значитnt fibrosis
Выраженный фиброз / цирроз Advanced fibrosis/cirrhosis
Чаще всего без необходимости в дальнейшем наблюдении